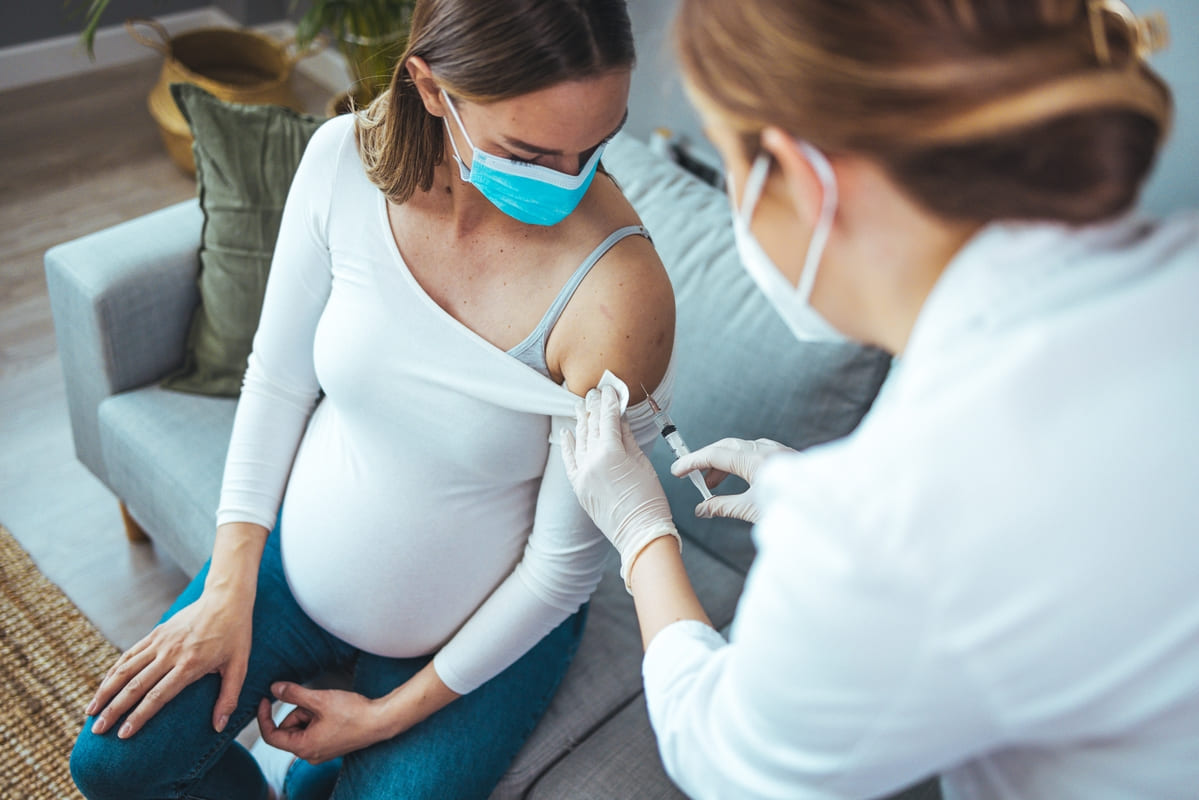
El pasado 21 de agosto, la FDA dio su visto bueno a la primera vacuna contra el virus sincitial respiratorio (VSR) que podrá ser administrada en mujeres embarazadas entre la semana 32 y 36 de gestación. El fármaco denominado Abrysvo también fue diseñado para proteger a los bebés desde el nacimiento y hasta los 6 meses de edad, por lo que aumentaría la respuesta inmune de los infantes contra este patógeno que puede causar infecciones letales en los primeros años de vida.
Cabe recordar que en mayo, la agencia estadounidense aprobó el uso de este fármaco en personas mayores de 60 años como medida preventiva para las enfermedades del tracto respiratorio inferior; específicamente aquellas que se han relacionado con el VSR. En este grupo poblacional, la vacuna se administra como una inyección intramuscular de dosis única.
Sobre esta decisión, la autoridad sanitaria a través del comunicado oficial indicó que, “Esta aprobación ofrece una opción a los profesionales sanitarios y a las embarazadas para proteger a los bebés de esta enfermedad potencialmente mortal”. De hecho, la gran mayoría de los infantes se infectan con el virus sincitial al menos una vez cuando alcanzan los 2 años de edad. Sin embargo, en los ensayos clínicos quedó demostrada la reducción de ese riesgo hasta en un 82%.
Datos de la vacuna contra el virus sincitial respiratorio en esta población
Para aprobar el uso de la vacuna en gestantes, la FDA evaluó la seguridad y eficacia de Abrysvo en la prevención de infecciones del tracto respiratorio inferior por VSR, incluyendo los casos severos con datos de estudios clínicos internacionales en curso, aleatorizados y controlados con placebo.
Entre las aproximadamente 3.500 embarazadas que recibieron Abrysvo, en comparación con las aproximadamente 3.500 embarazadas que recibieron placebo, se evidenció que el fármaco disminuyó el riesgo de infección del tracto respiratorio inferior en un 81,8% en los 90 días posteriores al nacimiento, y en un 69,4% en los 180 días posteriores al nacimiento.
Adicionalmente, en un subgrupo de participantes, cuya edad gestacional rondaba entre las 32 y las 36 semanas, dicho riesgo se redujo en un 34,7%; la disminución fue del 91.1% para infecciones respiratorias graves asociadas al virus sincitial respiratorio en los 90 días posteriores al nacimiento en comparación con el placebo.
Los efectos secundarios más frecuentes notificados por las embarazadas que recibieron Abrysvo fueron dolor en el punto de inyección, dolor de cabeza, dolor muscular y náuseas. Aunque no se notificó con frecuencia, se presentaron casos de preeclampsia en el 1,8% de las embarazadas que recibieron Abrysvo, en comparación con el 1,4% de quienes recibieron placebo. En los estudios de seguridad, el bajo peso al nacer y la ictericia en los recién nacidos se produjeron en mayor proporción en las embarazadas que recibieron la vacuna contra el virus sincitial respiratorio.