En este artículo, CONSULTORSALUD presenta los aspectos más relevantes del análisis de impacto normativo (AIN) para el Decreto 677 de 1995, en el que se integran los lineamientos para el registro sanitario y régimen de vigilancia sanitaria de medicamentos en el país, entre otros elementos que comprende dicha normativa.
El análisis parte de un hecho inquietante: los requisitos sanitarios definidos ya cuentan con 25 años de aplicación obligatoria, tiempo considerable en el que los mercados y las tecnologías de manufactura de medicamentos y otros productos sanitarios han obtenido avances en múltiples procesos. En contraparte, Colombia se ve rezagada en sus recomendaciones, pues han dejado de acoplarse a los estándares internacionales, hecho que ha sido manifestado a las autoridades sanitarias por parte de los diferentes actores.
Le puede interesar: Los hospitales Alejandro Próspero Reverend y Julio Méndez Barreneche vuelven a ser manejados por entes territoriales
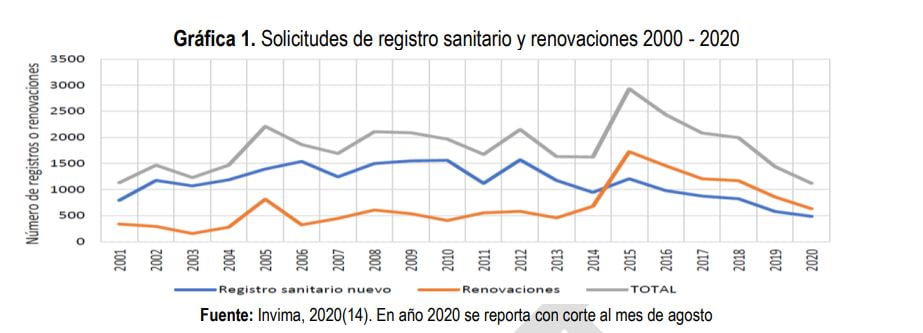
Cabe anotar que, si bien el Decreto 677 se mantiene vigente, se han realizado modificaciones al documento original, como resultado de las necesidades planteadas en materia de salud pública y razones de interés de los agentes sectoriales. Tal es el caso de la segmentación entre productos cosméticos, medicamentos homeopáticos, productos fitoterapéuticos, medicamentos biológicos y antivenenos, o, de los cambios realizados a la vigencia de los registros sanitarios de medicamentos, pasando de diez (10) a cinco (5) años, modificación que quedó registrada en el incremento de solicitudes entre 2015 y 2016, antes de la pandemia.
En cuanto al comportamiento del sector farmacéutico en el país, el análisis del Minsalud destaca a la fabricación, preparación y comercialización de productos farmacéuticos, bien sea de prescripción médica como de venta libre, para el diagnóstico, tratamiento o prevención de enfermedades; genéricos o innovadores como las actividades principales. Y aunque se menciona el crecimiento en la producción, se evidencia una menor proporción respecto a la demanda, requiriendo de la importación de medicamentos y otros productos para satisfacerla.
No olvide leer: Dispositivos médicos: Análisis de Impacto Normativo
“De igual forma, es importante resaltar que de las 306 empresas que reportan a la Superintendencia de Sociedades que pertenecen del sector farmacéutico, el 71 % se concentra en actividades de comercialización de medicamentos, mientras que sólo el 29 % de las empresas reportadas se dedican a la producción”
Por otra parte, en lo que se refiere a las ventas de medicamentos, los datos del Sistema de Información de Precios de Medicamentos -SISMED revelan que se vendieron medicamentos de 417 laboratorios titulares (incluyendo nacionales y extranjeros) para el año 2020, por un valor total de $15.1 billones de pesos, valor equivalente al 1.5% del PIB. Estas ventas corresponden en un 31,1% a los laboratorios establecidos en el país y en un 68.8% a ventas de laboratorios establecidos en el extranjero, se puede leer en el texto.
Le puede interesar: Etiquetado de alimentos ultraprocesados: Análisis del impacto normativo
Rigidez en la regulación de medicamentos, principal fallo del Decreto 677 de 1995
En el análisis de impacto normativo sobre medicamentos, las autoridades en salud reconocen que el problema con la normativa actual es a armonización inadecuada, vacíos regulatorios y rigidez de la regulación en términos de seguridad, calidad y eficacia para algunos medicamentos, lo cual se refleja en diversas situaciones:
- El Documento Técnico Común (CTD, por sus siglas en inglés), generado por el International Council
for Harmonisation – ICH, no se ha acogido en Colombia. - Colombia continúa otorgando certificaciones en buenas prácticas de manufactura bajo las estipulaciones del Informe 32 de la OMS, aun cuando se han acogido los Informes 37 y 45 de la organización internacional.
- Los medicamentos y establecimientos encargados del cumplimiento de los lineamientos se guían por un estándar menos estricto que los exigidos a nivel internacional. Por lo anterior, tampoco se establecen medidas adicionales tanto en el proceso de manufactura como de control de calidad.
Además de lo mencionado, al momento de la realización de este análisis (junio de 2022) no se cuenta con un documento estandarizado para el trámite de registro sanitario; es decir, la presentación de la información, trámites asociados y no se permite su homologación o reconocimiento con otras agencias sanitarias que así lo exigen, generando un impacto negativo sobre fabricantes o importadores.
No olvide leer: Lanzamiento del programa preventivo y predictivo de salud
Dentro de las consideraciones, CONSULTORSALUD resalta las observaciones sobre los productos innovadores, teniendo en cuenta que presentan diferencias respecto a la de los medicamentos de síntesis química. En ese sentido, aún se identifican vacíos en la regulación y diferencias con respecto a los procesos que deben seguir otros productos, medicamentos genéricos, por ejemplo.
“En materia de bioequivalencia en Colombia –a diferencia incluso de otros países de la región– no se ha adoptado el concepto de INTERCAMBIABILIDAD, recomendado por organismos internacionales para los medicamentos que demuestran equivalencia con medicamentos de referencia”, señala el análisis del Ministerio de Salud.
Retomando lo anterior y sumado al surgimiento de lineamientos actualizados a nivel global, queda claro que el Decreto 677 de 1995 es un documento que impide la implementación de estándares nuevos e incluso, la evaluación inicial debido al tiempo considerable establecido con dichos fines.
“Esto se ilustró aún más con la situación presentada en el año 2020 cuando fue evidente que la regulación no contemplaba de forma específica ni permitía adoptar con agilidad, mecanismos para abordar, de manera excepcional, los requisitos de un producto en un contexto de emergencia sanitaria”
No olvide leer: Otra que no se recupera: ordenan liquidación de Comfaguajira EPS
En las deficiencias detectadas, las autoridades también reconocen la deficiencia en la inspección, vigilancia y control (IVC) pos comercialización en el mercado farmacéutico. En ese sentido, las herramientas y acciones para verificar que estos sigan cumpliendo con los requerimientos que dan garantía de su calidad, seguridad e inocuidad, son pocos o inexistentes; las entidades encargadas están desarticuladas entre sí y presentan deficiencia en la inspección a nivel nacional. Algunos de los fallos más notorios son los siguientes:
- Falta de un programa robusto, continuo y amplio de muestreo y análisis de productos en el mercado. Actualmente existe un programa llamado DEMUESTRA la Calidad, pero este es limitado y no cuenta con los recursos y la continuidad que se requiere.
- Ausencia de un programa de trazabilidad por unidades de medicamento que permita realizar seguimiento y localización de los mismos en toda la cadena de suministro, pues aunque existe el Identificador Único de Medicamentos – IUM, como mecanismo para su identificación, este funciona más como un código específico para cada producto, estandarizando un conjunto de las características (atributos) del medicamento.
- La necesidad de fortalecimiento a los programas de Farmacovigilancia que son vitales a la hora de evidenciar potenciales efectos adversos que no hayan sido identificados en los estudios previos necesarios para la concesión de registro sanitario.
Le puede interesar: Supersalud “jala las orejas” a EPS de Bogotá por aumento de quejas
Falta control a los medicamentos desde el uso de nuevas tecnologías
Asimismo, las autoridades sanitarias reconocen que la integración de nuevas tecnologías es uno de los elementos en los que la normativa actual se queda corta. Pese a que a nivel internacional existen requisitos concretos en distintos rubros, en Colombia hay vacíos frente a: i) diferenciación entre los diseños de los productos de un mismo fabricante; ii) grafos o pictogramas que simbolicen información con significado para los usuarios y que eviten usos inadecuados, iii) sellos de seguridad o elementos que faciliten la diferenciación o la lectura de la información disponible de forma previa a su uso por el paciente (Ej. lenguaje Braille, diseño con colores diferenciados por producto, estrategias de etiquetado, etc.), entre otras.
Demoras en la resolución de solicitudes por parte del Invima
En el panorama nacional no es desconocida la gran cantidad de tiempo y los mecanismos implementados por el Invima para resolver trámites de registros sanitarios. Sin embargo, se trata de procesos que no son óptimos para ninguna de las partes en el mercado.
La raíz de este problema se ha identificado en varios ámbitos, entre ellos: dificultades para interpretar los requisitos por parte de los funcionarios del Invima y de los usuarios; la ARN no cuenta con suficiente cantidad de personal en términos de número y permanencia en el tiempo para atender las solicitudes que se reciben de los usuarios; las herramientas TIC disponibles en la ARN no tienen el alcance suficiente para agilizar los procesos y actividades de seguimiento.
Le puede interesar: Colombia adoptará convenio que mejora condiciones del personal de enfermería
Para superar las deficiencias en el régimen del registro sanitario de medicamentos, las autoridades en salud concluyeron que la alternativa que permitiría superar los aspectos abordados sería la emisión de un nuevo decreto de régimen del registro sanitario y derogatoria del Decreto 677 de 1995. Como principales beneficios se obtendrían:
- Robustecer la evaluación de los atributos de calidad, seguridad y eficacia de los medicamentos a través de la actualización oportuna y continua a estándares internacionales, la vigilancia permanente sobre el medicamento y la mayor predictibilidad en los términos del registro sanitario y los trámites asociados.
- Reducir los retrasos y las diferencias en la resolutividad de las solicitudes de registro, actividades de IVC y otros trámites, gracias al fortalecimiento de la regulación y la consecuente disminución de las diferencias de interpretación de requisitos por parte de los evaluadores y solicitantes, el mejor control de productos en el mercado con enfoque de riesgo, la facilitación de procesos operativos y la mayor credibilidad de la ARN.
- Minimizar los riesgos y daños del medicamento bajo una vigilancia pos comercialización fortalecida que permite identificar el cumplimiento de requisitos aprobados en el registro sanitario y que estos se mantengan durante la vigencia del mismo.
Lo invitamos a conocer el AIN sobre registro sanitario de medicamentos en Colombia a continuación:
No olvide leer: Cajacopi operará como EPS desde el 1 de diciembre