El Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) dio a conocer su informe de gestión 2022, un año de transición para las entidades del sector público. Vale la pena anotar que, en el segundo semestre de la vigencia, el Dr. Francisco Rossi se desempeñó como director encargado.
A nivel general, se llevaron a cabo 12.290 actividades de inspección, vigilancia y control en el territorio nacional. De ellas, 10.004 fueron acciones dirigidas hacia la producción de alimentos; 491 a medicamentos; 450 a dispositivos médicos y 104 a bancos de sangre. De acuerdo con el INVIMA, estas labores se realizan desde los Grupos de Trabajo Territorial.
Balance de la dirección
En el año 2022, se llevaron a cabo diversas actividades relacionadas con la certificación y vigilancia de dispositivos médicos y otras tecnologías en Colombia. Durante este periodo, se realizaron un total de 660 visitas con el propósito de certificación y seguimiento a importadores y fabricantes de dispositivos médicos y reactivos de diagnóstico in vitro.
Estas se llevaron a cabo de la siguiente manera: el 42% (277) de manera virtual, el 38,2% (252) de forma presencial en la ciudad de Bogotá y sus alrededores, y el restante 19,8% (131) a nivel nacional, lo que implicó gastos de tiquetes y viáticos. Cabe destacar que el 92,4% de las visitas correspondieron a dispositivos médicos, mientras que el 7,6% restante se relacionó con reactivos de diagnóstico.
En cuanto a las certificaciones, se observó que la mayoría de las visitas estuvieron dirigidas a importadores de dispositivos médicos, representando un 54,3% del total. Le siguieron las visitas de verificación de requerimientos con un 24,8% y las destinadas a la fabricación de dispositivos médicos con un 7,3%. Es importante resaltar que hubo un aumento del 1.550% en las visitas relacionadas con la fabricación de dispositivos médicos sobre medida de tecnología ortopédica externa en comparación con el año anterior.
Visitas de seguimiento
El tiempo de oportunidad para la ejecución de visitas nuevas de certificación con documentación completa, se observó que el promedio de días durante el año 2022 fue de 62 días hábiles, cumpliendo así con el plazo establecido por la norma de 90 días hábiles.
En relación a las certificaciones otorgadas, se realizaron 18 seguimientos, de los cuales el 88,9% se llevó a cabo en empresas fabricantes de dispositivos médicos y el 11,1% restante en importadores. Estas visitas se distribuyeron en diferentes ciudades de Colombia, siendo Cali, Medellín y Bogotá las que tuvieron mayor número de seguimientos. Durante estos seguimientos, fue necesario aplicar medidas sanitarias de seguridad, como la suspensión total de actividades y clausuras definitivas, debido a que los establecimientos no cumplían con las condiciones inicialmente certificadas. Estas medidas se aplicaron en un 44,4% de los casos.
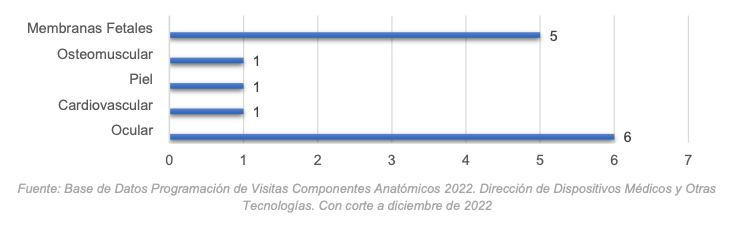
Tejidos Certificados en Buenas Prácticas en el 2022
Alertas sanitarias gestionadas
En el ámbito de las alertas sanitarias, se gestionaron un total de 290 casos, siendo 200 relacionados con dispositivos médicos y 90 con reactivos de diagnóstico in vitro. En el caso de los dispositivos médicos, se monitorearon 224 casos, de los cuales 67 correspondieron a alertas sanitarias y 133 a retiros de producto del mercado. Estos casos experimentaron un aumento del 12,99% en comparación con el año anterior, principalmente debido a fallas en el funcionamiento, calidad, fabricación, etiquetado, empaque y producto fraudulento.
Gestión de Alertas Dispositivos Médicos y Reactivos 2022
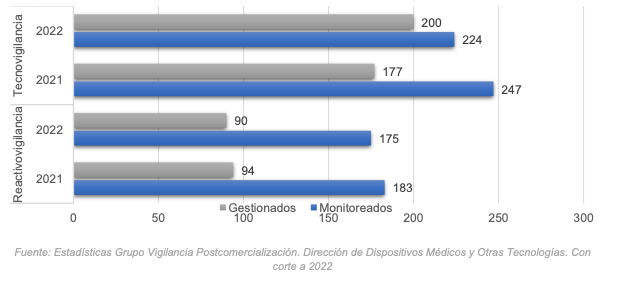
Los reactivos de diagnóstico in vitro fueron monitoreados 175 casos, de los cuales 90 aplicaron a Colombia. Estos casos se relacionaron principalmente con resultados falsos de pruebas, instrucciones de uso y rotulado o diseño. Se observó una disminución del 4,2% en comparación con el año anterior, debido al control y reducción en la importación de productos asociados con el tamizaje y diagnóstico del Covid-19.
Informes de seguridad en el informe de gestión de INVIMA
Se gestionaron un total de 281 casos, siendo 197 relacionados con dispositivos médicos y 84 con reactivos de diagnóstico in vitro. Estos informes se relacionaron principalmente con fallas en el funcionamiento, actualización de software, incompatibilidad con accesorios, instrucciones y recomendaciones de uso. Se observó una disminución del 23,64% en comparación con el año anterior, debido a los ciberataques sufridos por el Instituto.
Eventos adversos de dispositivos médicos
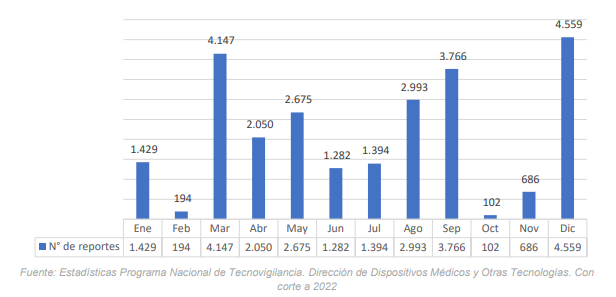
En relación a los eventos adversos, se recibieron 25.277 reportes asociados al uso de dispositivos médicos y equipos biomédicos, lo que representó un incremento del 12,66% en comparación con el año anterior. Durante el año 2022, se dio prioridad a los casos relacionados con dispositivos médicos utilizados en el tratamiento, diagnóstico y atención del Covid-19, en especial los relacionados con ventiladores. Las causas asociadas a estos eventos adversos fueron diversas, incluyendo errores de uso, fabricación, mantenimiento, componentes eléctricos, entre otros.
Eventos e Incidentes Adversos Relacionados con Dispositivos Médicos
Eventos reactivos
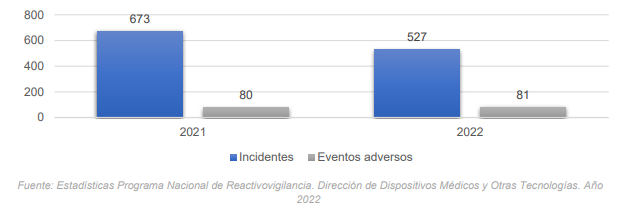
En cuanto a los reactivos de diagnóstico in vitro, se gestionaron un total de 608 efectos indeseados, siendo el 87% incidentes y el 13% eventos adversos. Las causas más reportadas fueron los falsos positivos, fallas en el empaque y en el uso de los reactivos de diagnóstico in vitro.
Reportes Relacionados con el Uso de Reactivos por Tipo de Evento Año 2022
Visitas de inspección, vigilancia y control en bancos de tejidos y médula ósea, bancos de medicina reproductiva
Durante el año 2022 se realizaron 52 visitas de inspección, vigilancia y control a los bancos de componentes anatómicos, tanto a los bancos de tejidos como a los bancos de gametos. Estas visitas se llevaron a cabo en establecimientos con nivel de riesgo muy alto, alto y medio, sin aplicar medidas sanitarias de seguridad.
En el programa denominado “Demuestra la Calidad”, se realizaron acciones de vigilancia a fabricantes e importadores de productos competencia del Invima. Se programaron inicialmente 50 muestras, pero solo se tomaron y entregaron 13 muestras debido a problemas con el servicio de transporte. Todas las muestras analizadas, correspondientes a jeringas y suturas, cumplieron con las especificaciones normativas y no fue necesario aplicar medidas sanitarias de seguridad.
Por último, se gestionaron un total de 37 solicitudes relacionadas con la inscripción de establecimientos fabricantes de dispositivos médicos vitales no disponibles y el reporte de agotamiento de existencias. Estas solicitudes fueron evaluadas y aprobadas en su mayoría, a excepción de aquellas que no estaban relacionadas con dispositivos médicos o reactivos de diagnóstico.