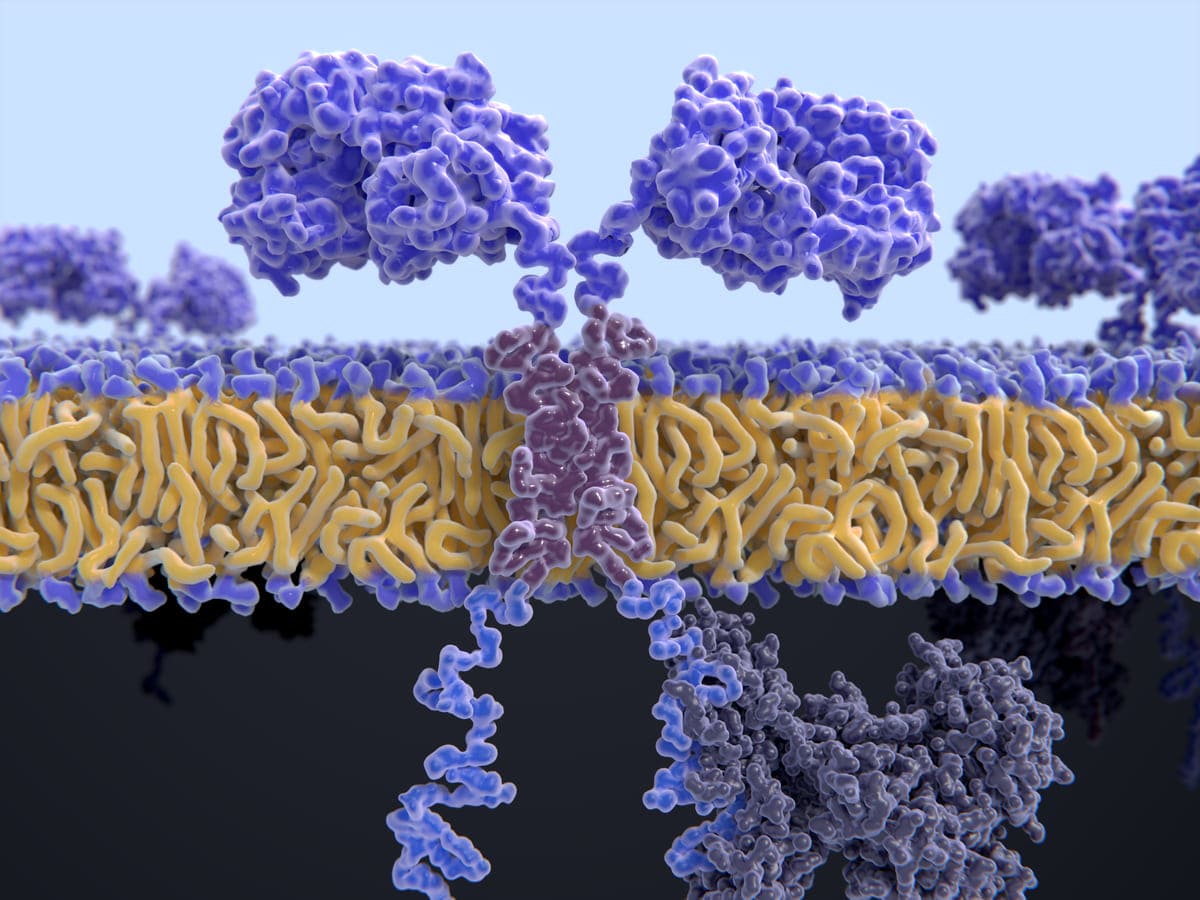
El pasado 28 de noviembre, la FDA comunicó que está investigando si las inmunoterapias con células T receptoras de antígenos quiméricos (CAR-T) pueden causar cánceres sanguíneos secundarios. No se trata de un riesgo nuevo asociado a estas terapias, conocidas como terapias CAR autólogas de células T dirigidas al antígeno de maduración de células B (BCMA) o dirigidas a CD19, y se incluyen en la información de prescripción.
Sin embargo, la FDA ha recibido 19 informes de cánceres secundarios, incluido el linfoma CAR-positivo, desde 2017, cuando se aprobaron los primeros tratamientos. Los reportes sobre las patologías oncológicas procedían del sistema de efectos adversos postcomercialización de la FDA y otros de datos de ensayos clínicos. Vale la pena resaltar que, esto no significa que las terapias dejen de administrarse a los pacientes que lo requieran, puesto que no se ha llegado a ninguna decisión final.
Hasta la fecha, la agencia sanitaria ha aprobado varias inmunoterapias de este tipo: abecma (idecabtagene vicleucel), breyanzi (lisocabtageno maraleucel), carvykti (ciltacabtagene autoleucel), kymriah (tisagenlecleucel), tecartus (brexucabtagene autoleucel) y yescarta (axicabtagene ciloleucel).
¿Qué podría explicar los reportes de cáncer derivados de tratamientos CAR-T?
De acuerdo con la FDA, las aprobaciones iniciales para estos productos incorporaron condiciones de postcomercialización (PMR) según la Sección 505(o) de la Ley Federal de Alimentos, Medicamentos y Cosméticos (FDCA).
Esto implicaba la realización de estudios observacionales de seguridad a largo plazo durante 15 años, con el propósito de evaluar tanto la seguridad a largo plazo como el riesgo de desarrollar neoplasias malignas secundarias después de la terapia.
Al final del documento, la FDA hace un par de recomendaciones, tanto a pacientes como a especialistas que prescriben CAR-T como opción terapéutica:
- Los pacientes y participantes en ensayos clínicos que reciban tratamiento con estos productos deben ser controlados de por vida para detectar la aparición de nuevas neoplasias malignas.
- En el caso de que se produzca una nueva neoplasia maligna tras el tratamiento con estos productos, póngase en contacto con el fabricante para notificar el acontecimiento y obtener instrucciones sobre la recogida de muestras del paciente para analizar la presencia del transgén del receptor de antígeno quimérico (CAR).
Se anima a los profesionales de la salud y a los pacientes a notificar los acontecimientos adversos o efectos secundarios relacionados con el uso de estos productos al Programa de Información sobre Seguridad y Notificación de Acontecimientos Adversos MedWatch de la FDA, completando el formulario en línea.