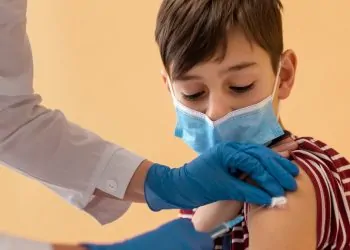
La Administración de Alimentos y Medicamentos (FDA) emitió una carta el pasado 30 de noviembre, a los fabricantes de isotretinoína, el medicamento utilizado para tratar el acné, exigiendo cambios en el programa iPLEDGE. Estos cambios tienen como objetivo mejorar la seguridad del medicamento y reducir la carga para los pacientes, las farmacias y los prescriptores.
En la reunión conjunta que se llevó a cabo en marzo de 2023, se discutieron los requisitos existentes del programa REMS de iPLEDGE (programa de distribución de gestión de riesgos ordenado por la FDA para la isotretinoína). Se tuvieron en cuenta los comentarios de los pacientes y los dermatólogos, y se recomendaron cambios para minimizar la carga del programa sin comprometer la seguridad de los pacientes.
Accesibilidad y la seguridad del tratamiento con isotretinoína
La FDA ha establecido cinco cambios que deben implementarse en un plazo de seis meses:
- Eliminar el requisito de que las pruebas de embarazo deben realizarse en un laboratorio especialmente certificado (es decir, Enmiendas para la mejora del laboratorio clínico – CLIA).
- Permitir a los médicos la opción de utilizar pruebas de embarazo caseras para sus pacientes durante y después del tratamiento con isotretinoína. Los médicos que dependen de la paciente para realizar una prueba de embarazo casera deben tomar medidas para minimizar la falsificación de los resultados de estas pruebas por parte de los pacientes. Según el Dr. Barbieri, esto significa que se deben realizar dos pruebas de embarazo antes de comenzar con la isotretinoína en un laboratorio o consultorio. “Sin embargo, todas las pruebas de embarazo en terapia pueden realizarse en un entorno médico o mediante una prueba de embarazo casera”, dijo a esta organización de noticias. “Esta opción facilita el uso de la telemedicina para que las pacientes no necesiten venir, solo pueden compartir una prueba de embarazo con su nombre y fecha con su dermatólogo”.
- Eliminar el requisito del período de espera, también conocido como “bloqueo de 19 días”, para los pacientes que no obtienen isotretinoína dentro del primer período de prescripción de 7 días. Según el Dr. Barbieri, este cambio ayuda a garantizar que los pacientes puedan comenzar a tomar isotretinoína de manera oportuna. “Los retrasos en los seguros y en la farmacia que no son culpa del paciente comúnmente pueden hacer que se pierdan los períodos de ventana iniciales”, dijo. “Permitir la repetición inmediata de una prueba de embarazo para iniciar un nuevo período de ventana, en lugar de requerir que la paciente espere 19 días más, puede garantizar la seguridad de la paciente y la prevención del embarazo sin afectar negativamente el acceso”.
- Revisar el requisito del registro de embarazos para eliminar el objetivo de documentar el embarazo y los resultados fetales de cada embarazo.
- Revisar el requisito para que los prescriptores documenten el asesoramiento a pacientes que no pueden quedar embarazadas de mensualmente a solo al momento de la inscripción. El Dr. Barbieri caracterizó este cambio como “importante” y dijo que podría eliminar la necesidad de visitas mensuales para personas en edad fértil. “Esto podría reducir sustancialmente las cargas logísticas para los pacientes y reducir los tiempos de espera para ver a un dermatólogo”, afirmó.
Estos cambios son un paso adelante para mejorar la accesibilidad y la seguridad del tratamiento con isotretinoína. Además, se espera que en el futuro se realicen más mejoras, como permitir pruebas de embarazo caseras antes del inicio del tratamiento y reducir el período de espera de 30 días a uno más corto.
El Dr. John S. Barbieri, director de la Clínica Terapéutica Avanzada del Acné del Brigham and Women’s Hospital, ha destacado la importancia de estos cambios para reducir la carga logística para los pacientes y mejorar el acceso a la atención dermatológica. También ha enfatizado la necesidad de una mayor transparencia por parte de los fabricantes de isotretinoína y la inclusión de aportaciones de diversas partes interesadas.