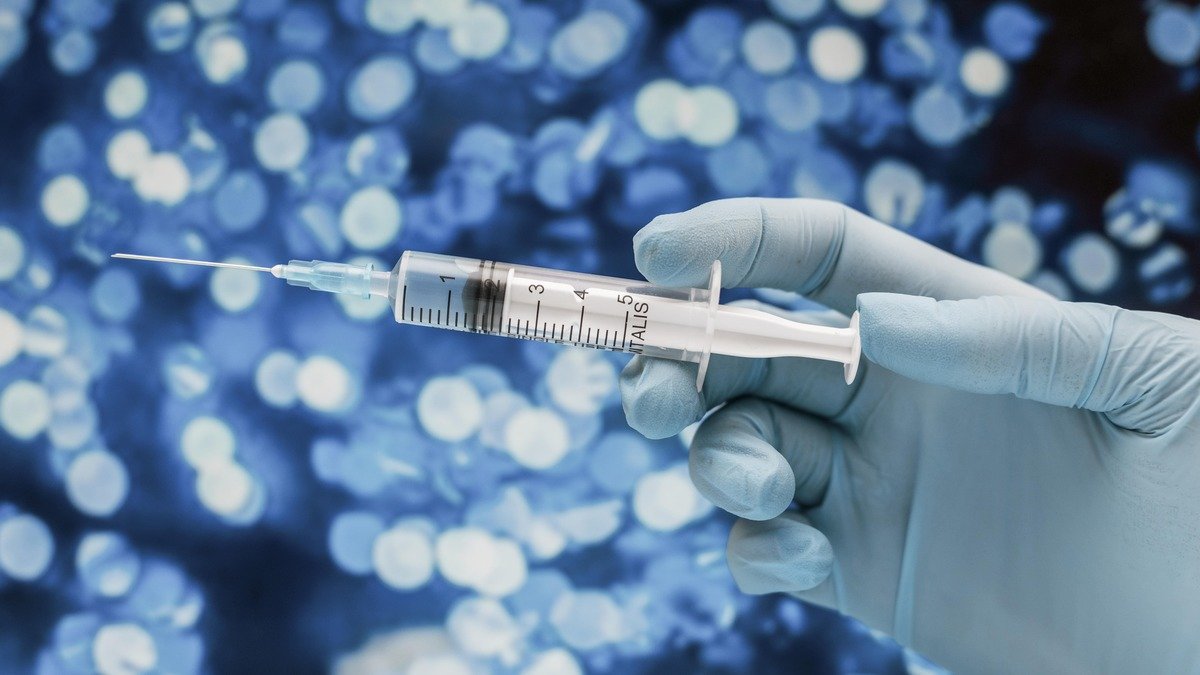
La Agencia Nacional de Vigilancia Sanitaria -Anvisa- de Brasil informó el sábado pasado que se autorizó la importación de dos millones de dosis de la vacuna contra el Covid-19 desarrollada por la gigante AstraZeneca en articulación con la Universidad de Oxford.
No obstante, la vacuna de la gigante británica aún no tiene autorización de uso en el país pero con su importación se aceleraría su aprobación lo que haría que la vacunación con estos viales comience apenas Anvisa apruebe su uso.
En el comunicado, el ente regulador resalta que el proceso de importación excepcional es una preparación para anticipar la disponibilidad de vacunas a partir de que el producto sea autorizado. Posterior a la llegada de los dos millones de dosis el centro biomédico Fiocruz será el encargado de mantener bajo custodia el fármaco hasta que el regulador lo apruebe, así mismo será este mismo centro el que se encargará de la administración de las dosis importadas y de la producción local del medicamento a partir del acuerdo de transferencia de tecnología establecido entre el consorcio británico y el Gobierno brasileño.
Así mismo, el documento menciona que las dosis llegarán al país este mismo mes aunque la autorización de emergencia y la aprobación de registro sanitario podrían demorar el inicio de la vacunación generalizada.
Brasil espera en estos primeros meses del año tener al menos 110 millones de dosis, equivalentes a la mitad de su población a través de una combinación de vacunas importadas y otras producidas directamente en el país (AstraZeneca), con este fin el Gobierno reservó los recursos en su presupuesto estatal. Se espera que con la inmunización de la mitad de su población el país alcance la inmunidad generalizada.
También puede leer: Resolución 2532 de 2020: Prueba PCR obligatoria para ingresar al país
Avance de la pandemia en Brasil
Las dosis que llegarán este mes, apuntó la Anvisa, fueron producidas en la India por el Serum Institute y forman parte de la plataforma Covaxx Facility, un programa global de la Organización Mundial de la Salud -OMS- para garantizar antivirus a todos los países y del cual Brasil forma parte.
Recordemos, que gracias al acuerdo de transferencia de tecnología con el Instituto Estatal Butantán de Sao Paulo, Brasil recibió 10.6 millones de vacunas desarrolladas por el laboratorio chino Sinovac, sin embargo, esta farmacéutica deberá presentar el resultado de la fase final de los ensayos clínicos y su porcentaje de eficacia el próximo 7 de enero ante la Anvisa.
Es decir, que Brasil cuenta a la fecha con dosis de Sinovac, AstraZeneca, Pfizer/BioNTech y Janssen, esta última además está realizando en el país estudios de fase tres con voluntarios que han recibido sus inmunizaciones.
Pese a la gran variedad ningún fabricante ha pedido autorización de uso de emergencia del medicamento ni ha presentado los documentos que se requieran para autorizar el uso de las vacunas.
Por otro lado, la vacuna rusa Sputnik V al no tener ensayos con voluntarios brasileños no está contemplada entre las vacunas a aprobar por la Anvisa pero podría incluirse si se pide un análisis de conclusión.
Finalmente, recordamos que Brasil, es uno de los tres países en el mundo más afectados por la pandemia del nuevo coronavirus en números absolutos junto a Estados Unidos e India, registró en las últimas 24 horas 15.827 nuevos casos y 314 muertes relacionadas a la covid-19, según informó este sábado el Gobierno.
También puede leer: Desarrollan nueva terapia para la pérdida de la audición