Con un proyecto de resolución, el Gobierno Nacional incluyó en la Planilla Integrada de Liquidación de Aportes – PILA -, un indicador para permitir el pago de los aportes al Sistema de Seguridad Social Integral y Parafiscales que suscriban con la UGPP facilidades de pago hasta el 30 de noviembre de 2020.
Con esta modificación se podrá incluir los acuerdos de pago celebrados por la Unidad Administrativa Especial de Gestión Pensional y Parafiscales (UGPP), teniendo en cuenta que la tasa de interés moratorio transitoria, equivalente a la tasa de interés diario bancario corriente para la modalidad de créditos de consumo y ordinario, certificado por la Superintendencia Financiera de Colombia, aplica tanto para el pago de obligaciones tributarias insolutas adeudadas al Sistema General de la Protección Social, que son objeto de verificación por parte de la UGPP, realizado desde la entrada en vigencia del Decreto Legislativo 688 de 2020, es decir el 22 de mayo de 2020 y hasta el treinta (30) de noviembre de 2020.
Q. Acuerdos o facilidades de pago realizados por la UGPP:
No obstante, cabe mencionar que este tipo de planilla solamente puede ser utilizada por aportantes que vayan a realizar el pago de aportes a los Sistemas Generales de Seguridad Social en Salud, Pensiones, Riesgos Laborales y Parafiscales derivados de acuerdos o facilidades de pago realizados por la UGPP.
Para el uso de este tipo de planilla el aportante y el cotizante deben estar relacionados con los Indicadores UGPP “8 – Acuerdos de pago” o “9 –Facilidades de pago” en el archivo PUB205RTRI que la UGPP envía al Ministerio a través de la Plataforma de Intercambio de Información (PISIS) del Sistema Integral de Información de la Protección Social – SISPRO, con periodicidad mensual o cuando se requiera, y dispuesto de la misma forma a los Operadores de Información.
- “Indicador UGPP” 8 (Acuerdos de pago): suscripción de acuerdos de pagos con la UGPP en virtud de la ley 2010 del 2019 y el decreto 688 del 2020.
- “Indicador UGPP” 9 (facilidades de pago): suscripción de facilidades de pago con la UGPP hasta el 30 de noviembre.
También puede leer: páncreas artificial para diabetes tipo 1 en niños fue aprobado por la FDA
De igual manera, este tipo de planilla no validará la información de los valores definidos en los campos Ingreso Base de Cotización, tarifa, cotización e intereses de mora y permitirá el recaudo de los valores reportados por el aportante establecidos en los acuerdos de pago suscritos con la UGPP.
Cuando el aportante utilice y pague este tipo de planilla, el operador no liquidara los intereses de mora a que haya lugar y permitirá que el aportante indique el valor establecido con la UGPP en los acuerdos de pago.
Cálculo de los intereses de mora de acuerdo con la clase de aportante
El pago de aportes al Sistema de Seguridad Social Integral y Parafiscales de periodos comprendidos entre febrero de 1995 y septiembre de 1999 deberá ser efectuado en el mes siguiente a aquel que es objeto de las cotizaciones en los siguientes plazos:
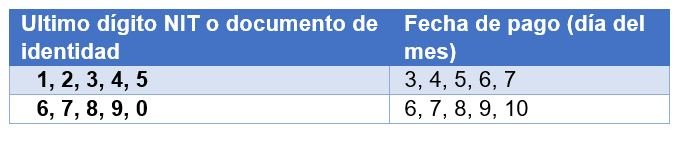
- Para el pago de aportes al Sistema de Seguridad Social Integral y Parafiscales de periodos comprendidos entre octubre de 1999 y mayo de 2007, se tomarán los plazos establecidos en la normatividad vigente en dichos periodos.
- Para el pago de aportes al Sistema de Seguridad Social Integral y Parafiscales de periodos comprendidos entre octubre de 1999 y mayo de 2007, se tomarán los plazos establecidos en la normatividad vigente en dichos periodos.
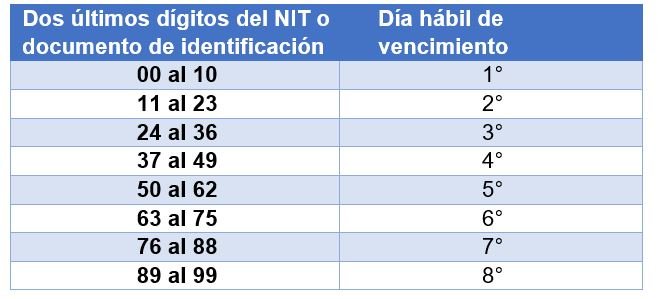
Aportantes de 200 o más cotizantes
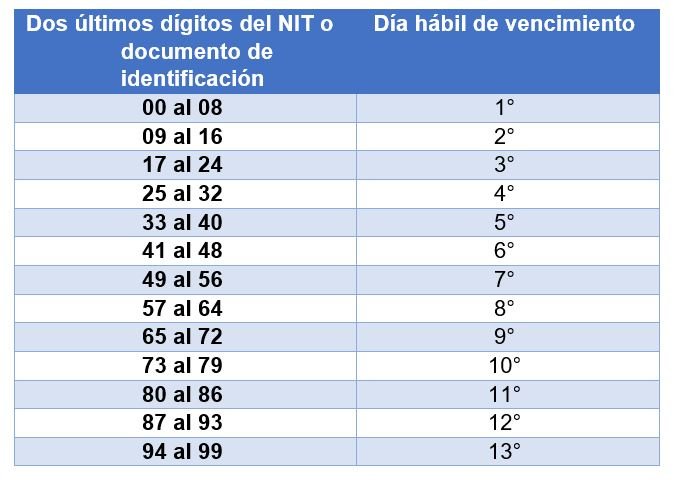
Aportantes de menos de 200 cotizantes
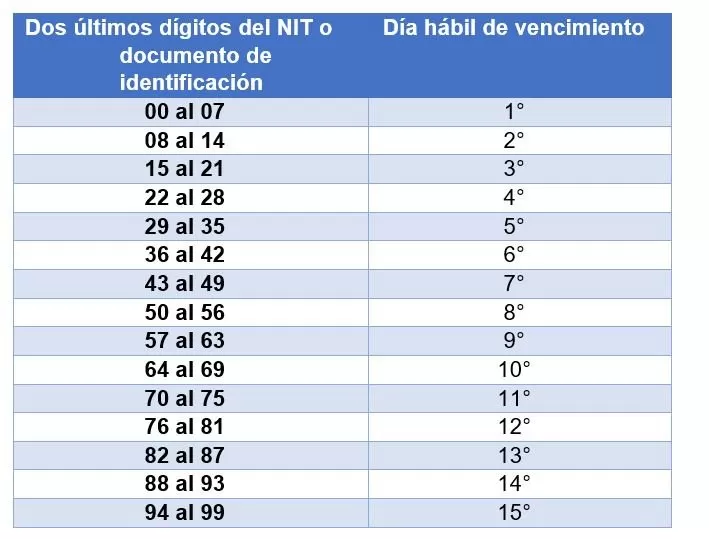
Trabajadores independientes
Para el pago de aportes al Sistema de Seguridad Social Integral y Parafiscales desde el 6 de marzo de 2017, se tomarán los plazos establecidos en los artículos 3.2.2.1, 3.2.2.2 y 3.2.2.3 del Decreto 780 de 2016 o la norma que lo modifique o sustituya.












































