La semana pasada, la Administración de Alimentos y Medicamentos de EE.UU. (FDA) ha aprobado hoy el uso de quizartinib (Vanflyta) en adultos con leucemia mieloide aguda (LMA) portadores de la mutación genética FLT3-ITD.
Con ello, concedió una indicación de primera línea para su uso en combinación con quimioterapia estándar -inducción con citarabina y antraciclina seguida de consolidación con citarabina- y como monoterapia de mantenimiento posterior, en adultos cuyos tumores expresen FLT3-ITD. Sin embargo, el fármaco no puede considerarse como monoterapia de mantenimiento tras un trasplante alogénico de células madre hematopoyéticas.
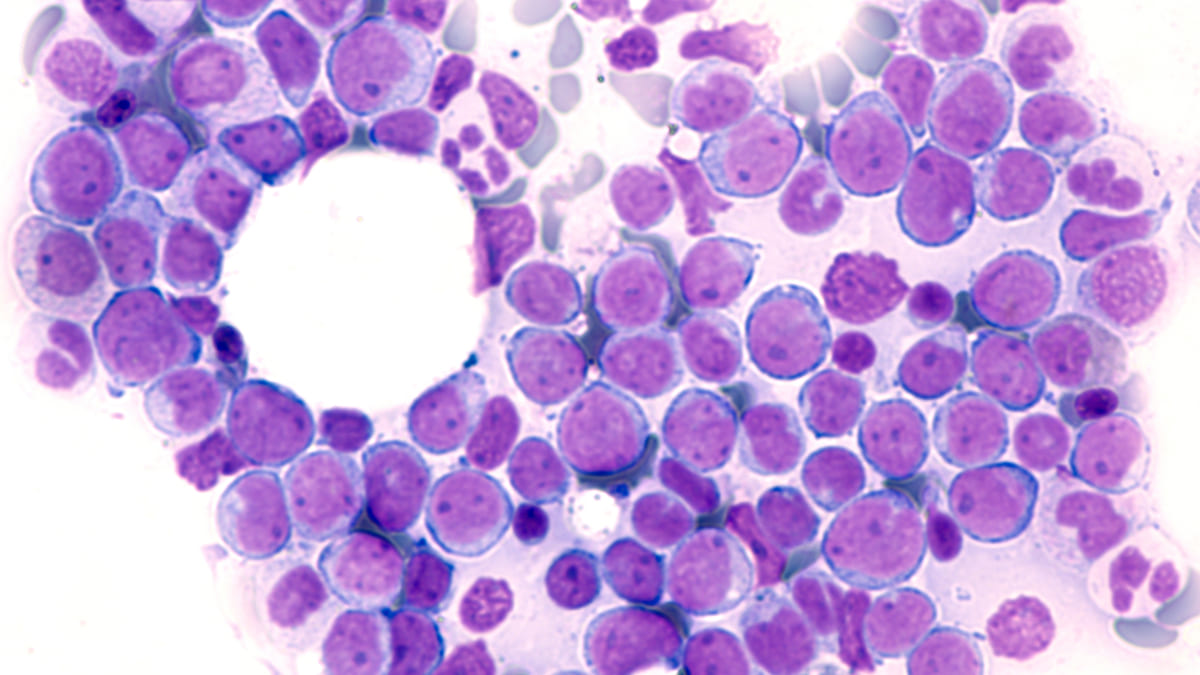
La proteína FLT3 es un receptor tirosina cinasa que se encuentra en las células madre hematopoyéticas. El FLT3 de tipo salvaje favorece la supervivencia, el crecimiento y la diferenciación celular, pero el FLT3 mutado por ITD [duplicación interna en tándem], al que se dirige el quizartinib, se asocia a un mayor riesgo de recaída y a una menor supervivencia.
De acuerdo con datos entregados por la FDA, aproximadamente una cuarta parte de los pacientes con leucemia mieloide aguda son portadores de esta mutación. Hasta el 37% de los pacientes recién diagnosticados de LMA presentan una mutación del gen FLT3, explica la compañía farmacéutica Daiichi Sankyo.
La fecha original de la decisión era el 24 de abril, pero la agencia la retrasó 3 meses para revisar las actualizaciones que se hicieron al programa de Estrategias de Evaluación y Mitigación de Riesgos (REMS) del quizartinib. Esto último fue una petición directa de la agencia estadounidense.
¿Qué datos fueron relevantes para la aprobación de esta opción terapéutica para la leucemia mieloide aguda?
La aprobación se basó en el ensayo de fase 3 QuANTUM-First en más de 500 pacientes con la mutación. La mediana de la supervivencia global entre los pacientes en quimioterapia estándar asignados aleatoriamente a quizartinib fue de 31,9 meses frente a 15,1 meses en los pacientes que recibieron el placebo, lo que supone una reducción del 22,4% del riesgo de muerte (p = 0,0324).
La seguridad del medicamento se evaluó en 265 pacientes con leucemia mieloide aguda FLT3-ITD positiva de nuevo diagnóstico. “En el ensayo QuANTUM-First, VANFLYTA añadido a la quimioterapia estándar y continuado como mantenimiento dio lugar a una mayor remisión y prolongó la supervivencia global, y será una nueva opción terapéutica muy necesaria que tiene potencial para cambiar la forma en que se trata la LMA positiva para FLT3-ITD”, mencionó el Dr. Harry P. Erba, perteneciente al Instituto del Cáncer Duke.
En el ensayo revisado por la FDA, los efectos adversos más frecuentes con quizartinib fueron linfopenia (60%), hipopotasemia (59%), hipoalbuminemia (53%), hipofosfatemia (52%), aumento de la fosfatasa alcalina (51%), hipomagnesemia (44%), neutropenia febril (44%), diarrea (42%), mucositis (38%), náuseas (34%) e hipocalcemia (33%), entre otros.
Los acontecimientos adversos de grado 3/4 más frecuentes fueron neutropenia febril (43% con quizartinib frente a 41% con placebo); neutropenia (18% frente a 9%); hipopotasemia (19% frente a 16%); y neumonía (11% en ambos casos).