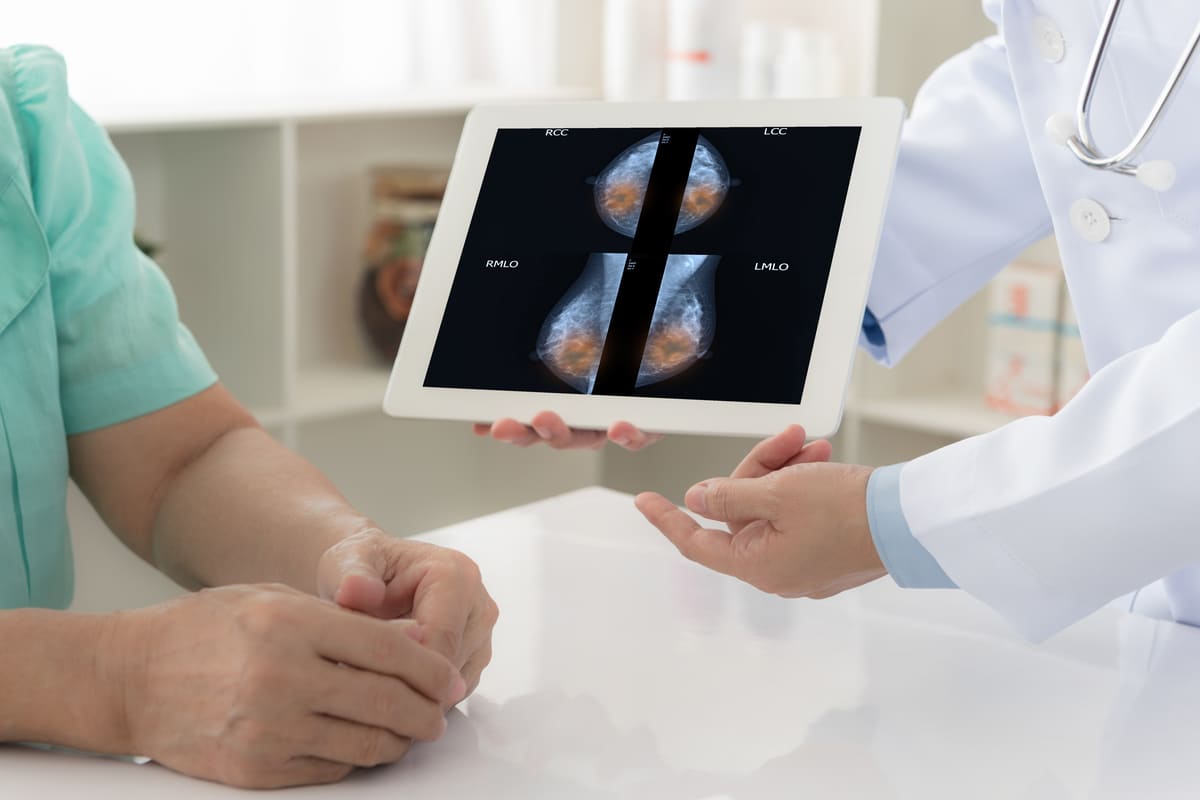
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha aprobado hoy una nueva indicación de sacituzumab govitecan, medicamento desarrollado por Gilead Sciences y comercializado bajo el nombre de Trodelvy.
La indicación de uso está dirigida a pacientes de cáncer de mama metastásico, localmente avanzado o no resecable. Otros de los requisitos para que el medicamento sea administrado como tratamiento es que el cáncer sea positivo para receptores hormonales (RH) y negativo para HER2, tras un tratamiento endocrino y al menos dos terapias sistémicas adicionales para la enfermedad metastásica.
También le puede interesar: El 8% de muertes en México están asociadas al cáncer
La modificación sobre el uso del fármaco está basada en el ensayo clínico TROPICS-02, el cual aleatorizó a 543 adultos 1:1 para recibir sacituzumab govitecan 10 mg/kg IV los días 1 y 8 de un ciclo de 21 días o quimioterapia con un único agente, la mayoría de las veces eribulina, aunque también se documentó el empleo de vinorelbina, gemcitabina o capecitabina.
Antes de este cambio, el sacituzumab govitecan fue aprobado previamente para el cáncer de mama triple negativo irresecable, localmente avanzado o metastásico después de dos o más terapias sistémicas previas y el cáncer urotelial localmente avanzado o metastásico después de quimioterapia basada en platino y un inhibidor de PD-1 o PD-L1.
No olvide leer: ISP de Chile reportó balance sobre importación de medicamentos
Integrar el fármaco superó expectativas frente a los resultados en los pacientes con cáncer de mama
En cuanto a los datos sobre la supervivencia sin progresión, los resultados del ensayo muestran que fue de 5.5 meses tras usar el fármaco aprobado frente a 4 meses con quimioterapia de agente único. A nivel global, el promedio de supervivencia fue de 14.4 meses en el grupo de sacituzumab govitecan frente a 11.2 meses con quimioterapia.
“Hemos tenido opciones limitadas para ofrecer a los pacientes de cáncer de mama después de la terapia endocrina y la quimioterapia, y para ver un beneficio de supervivencia clínicamente significativa de más de 3 meses con un beneficio de calidad de vida para estas mujeres es excepcional” mencionó Hope Rugo, especialista en cáncer de mama de la Universidad de California en San Francisco e investigadora principal de TROPICS-02.
En el comunicado oficial, la FDA también hace un recuento de los eventos adversos asociados al medicamento: disminución del recuento de leucocitos, disminución del recuento de neutrófilos, disminución de la hemoglobina, disminución del recuento de linfocitos, diarrea, fatiga, náuseas, alopecia, elevación de la glucosa, estreñimiento y disminución de la albúmina. Además, en el etiquetado del producto figura una advertencia de recuadro negro sobre neutropenia grave o potencialmente mortal y diarrea grave.
No olvide leer: Gran Encuesta del Sector Salud: el 73% de colombianos está conforme con el sistema actual