En el marco de la conmemoración del día Mundial de las Enfermedades Huérfanas o Raras, la Agencia Europea del Medicamento (EMA) ha recomendado conceder la autorización de comercialización en la Unión Europea el Qalsody (tofersen), una nueva terapia para el tratamiento de pacientes adultos con esclerosis lateral amiotrófica (ELA) que tienen una mutación en el gen del superóxido dismutasa 1 (SOD1).
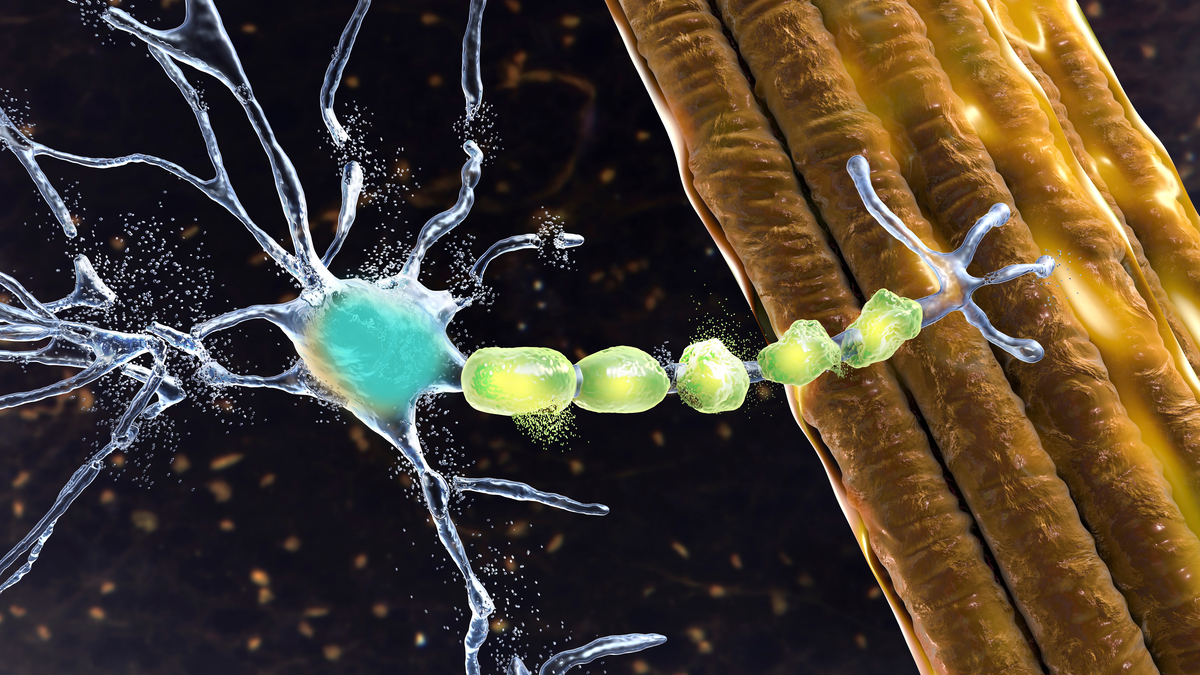
La ELA es una enfermedad neurodegenerativa que afecta a las células nerviosas responsables del movimiento voluntario en el cerebro y la médula espinal. Con el tiempo, estas células se deterioran, lo que provoca una pérdida progresiva de la función muscular y eventualmente parálisis, incluyendo los músculos respiratorios, lo que lleva a una insuficiencia respiratoria. La ELA es una enfermedad devastadora con un tiempo medio de supervivencia de dos a cinco años.
Hasta el momento se desconocen las causas exactas de la ELA, pero científicos reconocen que influyen factores genéticos y ambientales. En alrededor del 2% de los pacientes con esclerosis lateral amiotrófica (ELA), la enfermedad se debe a una mutación genética que afecta la producción de enzimas SOD1. Estas enzimas defectuosas pueden desencadenar la muerte de las células nerviosas, contribuyendo así al progreso de la enfermedad.
Qalsody (tofersen): Tratamiento para los pacientes con ELA, enfermedad huéfana
Actualmente, la Unión Europea ha autorizado un solo tratamiento para la ELA denominado riluzol y, además, se ofrece tratamiento de apoyo para aliviar los síntomas de la enfermedad, como terapia física, ocupacional o del habla y apoyo respiratorio. De esta manera, existe una gran necesidad medida de terapias eficaces que preserven la función muscular y prologue la vida de estos pacientes.
Específicamente, Qalsody es un oligonucleótido antisentido que se utiliza para tratar la esclerosis lateral amiotrófica (ELA). Funciona uniéndose al ARNm del gen SOD1, lo que reduce la producción de la proteína SOD1. Al disminuir la cantidad de esta proteína defectuosa, se espera que Qalsody mejore los síntomas de la ELA y ayude a frenar la progresión de la enfermedad.
Entre tanto, la opinión del Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) se basa en una evaluación exhaustiva de la evidencia disponible sobre un medicamento, que incluye diversos aspectos. Esto incluye la forma específica en que actúa el fármaco, los efectos observados en modelos animales que presentan la mutación SOD1 (un modelo utilizado para simular la ELA en el laboratorio), biomarcadores que pueden indicar la eficacia y seguridad del medicamento, así como datos clínicos de estudios en humanos.
Al considerar todos estos aspectos, el CHMP evalúa la eficacia y seguridad del medicamento y emite una opinión sobre su aprobación para su uso en pacientes.
Datos clínicos del Qalsody
Los datos clínicos del Qalsody fueron obtenidos de un ensayo clínico aleatorizado, doble ciego y controlado con placebo que duró 28 semanas y que involucró a 108 pacientes con debilidad atribuible a la ELA y una mutación confirmada en el gen SOD1. Los pacientes fueron asignados al azar en una proporción de 2:1 para recibir tratamiento intratecal con Qalsody o placebo durante 24 semanas.
Durante el estudio, se midió la concentración de la cadena ligera de neurofilamentos plasmáticos (NfL) como un marcador de daño neuronal. Se observaron reducciones significativas de alrededor del 60% en las concentraciones plasmáticas de NfL en los pacientes que recibieron Qalsody en comparación con los del grupo placebo, lo que sugiere una disminución en el daño neuronal.
Además, se registró una mejora numérica en las capacidades físicas de los pacientes tratados con Qalsody en comparación con los del grupo placebo, medida mediante la escala de calificación funcional conocida como ‘Escala de calificación funcional revisada de la ELA’ (ALSFRS-R). Estos resultados respaldan la eficacia potencial de Qalsody en el tratamiento de la ELA.
Por su parte, la recomendación hecha por el CHMP es la de una autorización de comercialización en circunstancias excepcionales para Qalsody. Esta vía de autorización permite a los pacientes acceder a medicamentos sobre los cuales no se pueden obtener datos completos en condiciones normales de uso, ya sea porque hay muy pocos pacientes con la enfermedad, la recopilación de información completa sobre la eficacia y seguridad del medicamento no sería ética, o existen lagunas en el conocimiento científico.
Estos medicamentos están sujetos a obligaciones y seguimiento específicos posteriores a la autorización para garantizar que se recopile más información sobre su eficacia y seguridad mientras están en uso clínico.
Igualmente, el CHMP solicitó que se proporcionara datos adicionales después de la autorización para mejorar la comprensión de la eficacia y seguridad a largo plazo de Qalsody. Esto incluye la realización de un estudio de extensión abierto a largo plazo, la colaboración con dos registros de enfermedades y un estudio observacional basado en registros. Además, se planea investigar si el uso de tofersen puede retrasar o incluso prevenir la aparición clínica de la ELA en pacientes que tienen la mutación SOD1, pero aún no muestran síntomas de la enfermedad.
Efectos secundarios del Qalsody
Es importante mencionar que el estudio arrojo algunos efectos secundarios que se presentaron con mayor frecuencia durante el uso de Qalsody. Entre los síntomas reportados fueron dolor, fatiga, fiebre (pirexia), dolor en las articulaciones (artralgia), dolor muscular (mialgia), así como un aumento en los niveles de glóbulos blancos y proteínas en el líquido cefalorraquídeo (el fluido que rodea el cerebro y la médula espinal).