Las empresas desarrolladoras de dispositivos médicos se centraron en los últimos años en desarrollar tecnologías de diagnóstico de varias enfermedades. Esta decisión no es fortuita ya que la FDA y la EMA tardan mucho menos tiempo en aprobar productos diagnósticos que tecnologías más robustas y complicadas como equipos hospitalarios e implantes cardíacos.
Un análisis del número y la velocidad de las aprobaciones de tecnologías médicas innovadoras por parte de la FDA en los últimos cinco años coloca a los fabricantes de pruebas Roche y Qiagen a la cabeza, mientras que los desarrolladores de tecnologías más complejas se quedan atrás.
Sin embargo, las estrategias de crecimiento y desarrollo de las compañías especializadas en dispositivos médicos no son del todo claras, como si lo son las jugadas de las gigantes desarrolladoras de medicamentos, resulta comprensible entonces que varias empresas tengan estos dos segmentos de cartera (fármacos y dispositivos médicos).
Algunas compañías optan por desarrollar tecnologías innovadoras de manera interna, mientras que otras prefieren obtenerlas mediante la compra de empresas más pequeñas o fusiones.
El análisis a continuación considera las empresas que recibieron al menos cinco aprobaciones previas a la comercialización por primera vez de la FDA, exenciones de dispositivos humanitarios o autorizaciones 510(k) de novo entre principios de 2017 y fines del año pasado. Estos caminos regulatorios se utilizan para tecnologías médicas a diferencia de todo lo que ya está en el mercado: productos que representan verdaderos avances.
También puede leer: Conozca el proceso de adopción del Plan Decenal de Salud Pública 2022 – 2031
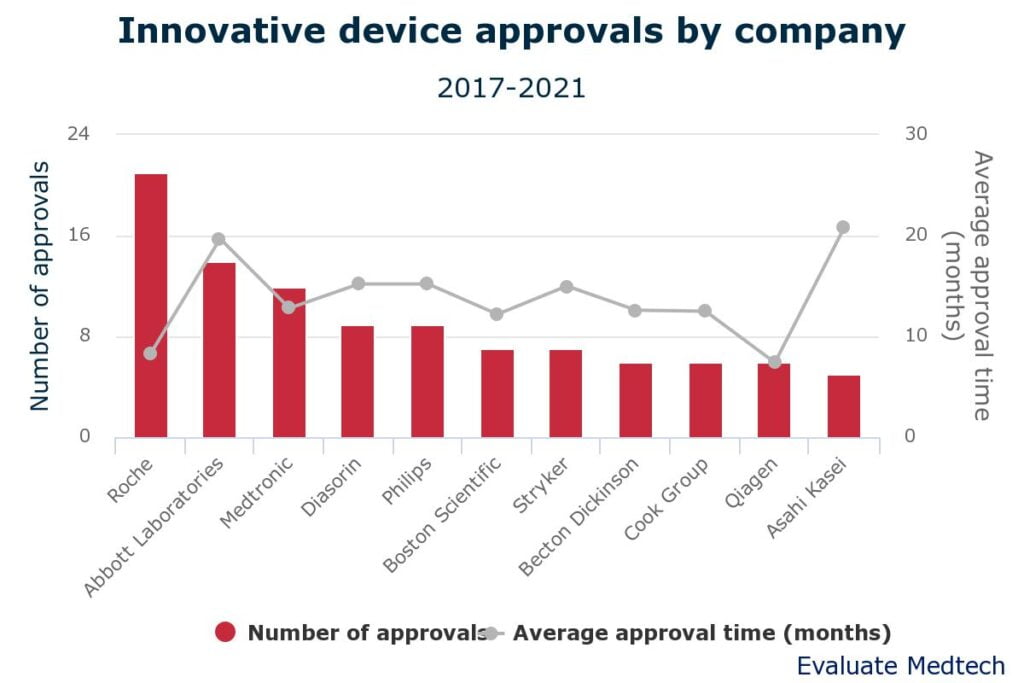
En estas condiciones, Roche (su segmento de dispositivos médicos) lidera el conteo con 21 aprobaciones, todas para diagnóstico in vitro. Todos sus desarrollos eran para facilitar el diagnóstico o clasificación de algún tipo de cáncer, incluyendo biopsias líquidas. Siendo tecnologías de fácil uso y no invasivas su aprobación fue muy veloz, de hecho los 21 productos de Roche recibieron aprobación en una media de 8.3 meses por parte de la FDA.
Sin embargo, si de aprobaciones agiles se trata, la compañía de pruebas Qiagen, especializada en la perfilación de tumores tuvo un promedio de 7.4 meses para la aprobación de sus tecnologías diagnosticas, incluyendo una prueba capaz de predecir el riesgo de parto prematuro.
Es preciso decir, que ambas compañías también diseñaron y desarrollaron pruebas covid, pero estas no están contempladas en este análisis ya que llegaron al mercado por medio de aprobaciones de uso de emergencia.
Artículo exclusivo: FDA revisará el tratamiento farmacológico de AbbVie para el Parkinson
Por supuesto, los fabricantes de diagnósticos pueden pasar por alto a la FDA si lo desean, comercializando sus pruebas a través de la exención de Clia en lugar de buscar una aprobación formal. De hecho, la mayoría de las compañías diagnosticas optan por esta vía, por lo que este análisis solo brinda una pequeña perspectiva de las aprobaciones de la FDA.
Todas las tecnologías aprobadas por la FDA de Qiagen en el último lustro se desarrollaron orgánicamente gracias a esfuerzos de I+D, lo mismo sucede con Roche, aunque uno de sus dispositivos médicos aprobados fue fruto de la adquisición de una compañía. La otra compañía cuyos esfuerzos se deben únicamente al I+D interno es Diasorin.
También puede leer: La FDA aprueba el primer tratamiento no farmacológico para la fibromialgia
De las 11 empresas mostradas, Becton Dickinson es la más interesada en comprar innovación. Muchos de sus productos aprobados se obtuvieron a través de la adquisición de CR Bard en 2017, incluidos los stents Covera y Venovo. La compra de Lutonix suministró el desarrollo para la angioplastia recubierto de fármaco del mismo nombre. BD es el claro ejemplo de que las compras y fusiones también pueden dar resultado ya que los dispositivos médicos que compró fueron evaluados y aprobados por la FDA un promedio de seis meses más rápido que los productos que la compañía desarrolló internamente.
Tiempos de aprobación promedio de dispositivos médicos en Estados Unidos
| Empresa | % desarrollado internamente | Tiempo promedio de aprobación interna (meses) | Tiempo de aprobación promedio comprado en (meses) |
| Becton Dickinson | 17% | 17.7 | 11.6 |
| Philips | 78% | 17.5 | 7.3 |
| asahi kasei | 80% | 7.4 | 18.5 |
| Medtronic | 83% | 12.3 | 15.3 |
| Laboratorios Abbott | 86% | 11.8 | 67,6* |
| boston cientifico | 86% | 12.9 | 8.4 |
| Stryker | 86% | 15.3 | 13.0 |
| Roche | 95% | 8.0 | 6.0 |
| Grupo de cocina | 100% | 12.5 | – |
| Diasorin | 100% | 15.2 | – |
| Qiagen | 100% | 7.4 | – |
| Promedio | 12.5 | 19 |
Recordemos que para que se considere comprado, la presentación reglamentaria de un dispositivo debe haber sido realizada por una empresa que posteriormente fue comprada por el destinatario de la aprobación. De hecho, para la mayoría de estos grupos, los productos que llegaron a través de adquisiciones completaron la revisión de la FDA más rápidamente que los desarrollados internamente.












































