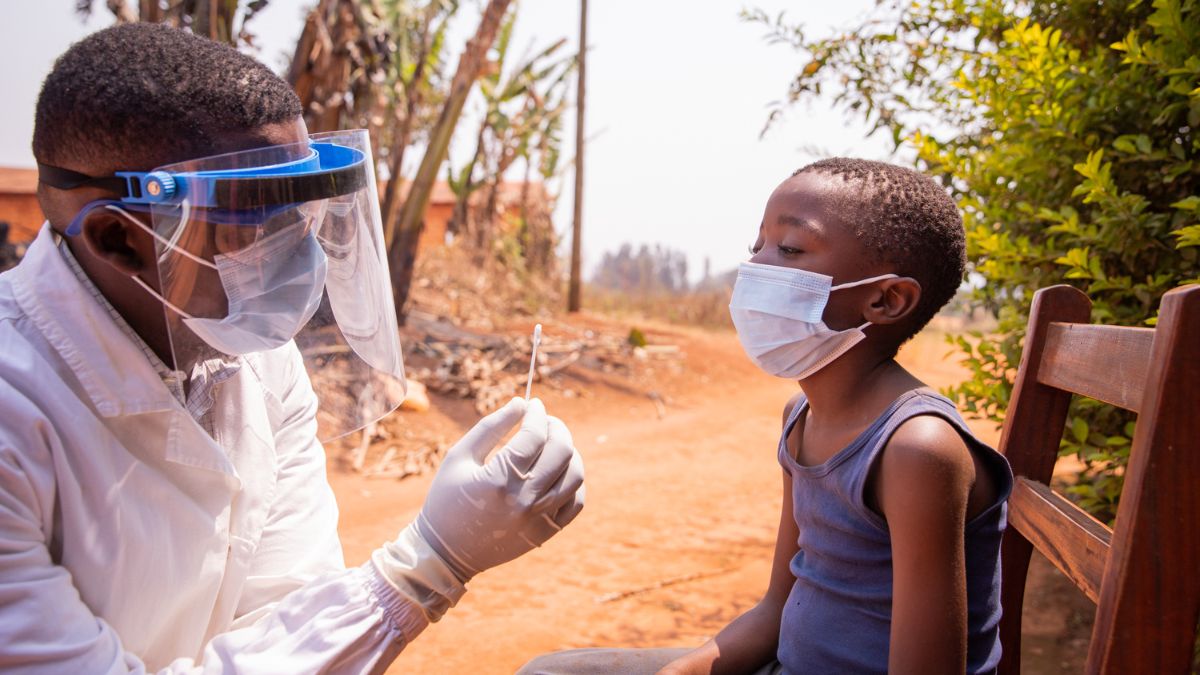
La Organización Mundial de la Salud (OMS) incluyó dos pruebas de diagnóstico de viruela símica (mpox) adicionales en su lista de uso en emergencias, una medida diseñada para fortalecer las opciones de detección y facilitar un diagnóstico rápido en contextos con recursos limitados. Esta adición representa un avance significativo en la capacidad de respuesta ante brotes, especialmente en países de ingresos medianos y bajos, donde el acceso a pruebas de calidad ha sido históricamente limitado.
La lista de uso en emergencias de la OMS permite la aprobación acelerada de productos de diagnóstico que cumplen con estrictas normas de seguridad, calidad y desempeño. Estas pruebas son vitales en la identificación temprana del mpox, enfermedad que en 2024 ya ha afectado a más de 40,000 personas en África, siendo la República Democrática del Congo el país más afectado.
En este contexto, la OMS ha incluido dos pruebas de PCR (reacción en cadena de la polimerasa), que representan el método estándar para el diagnóstico de mpox debido a su precisión en la detección de ADN viral. La primera, llamada Xpert Mpox, fabricada por Cepheid, permite un diagnóstico rápido en menos de 40 minutos y es compatible con los sistemas GeneXpert. La segunda, cobas® MPXV de Roche Molecular Systems, Inc., tiene la capacidad de detectar ambos clados del virus en un plazo de dos horas, siendo apta para laboratorios con alta demanda de procesamiento.
Tecnología y velocidad: Xpert mpox y cobas® MPXV
La prueba Xpert Mpox, aprobada el 25 de octubre de 2024, se administra a través de un cartucho colocado en el sistema GeneXpert, una tecnología que permite la descentralización de los diagnósticos y su uso en áreas cercanas al punto de atención. Según la OMS, el sistema GeneXpert garantiza la automatización completa del proceso, lo cual simplifica la administración de la prueba y permite obtener resultados fiables en menos de una hora. Este aspecto es particularmente importante en entornos donde el acceso a infraestructura de laboratorio es limitado y se requieren diagnósticos inmediatos.
Por su parte, la prueba cobas® MPXV, incluida en la lista de emergencias de la OMS el 14 de octubre, utiliza los sistemas cobas 6800/8800, los cuales permiten procesar varias muestras al mismo tiempo. Esto hace que sea una opción ideal para laboratorios con un gran volumen de pruebas, optimizando la capacidad de respuesta en situaciones de alta demanda. Con esta tecnología, los laboratorios pueden obtener resultados de alta precisión en un tiempo relativamente corto, agilizando la toma de decisiones clínicas y las acciones de salud pública para contener el brote.
La importancia de un diagnóstico oportuno
“Garantizar el acceso mundial a unas pruebas para el diagnóstico de la mpox que cumplan las normas de la OMS desde el punto de vista de la calidad, la seguridad y el desempeño es fundamental para que los entornos donde hay brotes de mpox dispongan de pruebas eficientes y eficaces”, declaró el Dr. Rogerio Gaspar, Director de Reglamentación y Precalificación de la OMS. La rapidez y la precisión de estas pruebas no solo son vitales para el diagnóstico y tratamiento temprano de los pacientes, sino también para la prevención de la propagación del virus, lo que contribuye a evitar brotes a mayor escala.
Desde la declaración de mpox como Emergencia de Salud Pública de Importancia Internacional (ESPII) el 14 de agosto de 2024, la OMS ha solicitado a los fabricantes de diagnósticos in vitro que expresen su interés en incluir sus productos en la lista de uso en emergencias. Este llamado ha generado más de 60 expresiones de interés, de las cuales siete se han convertido en solicitudes formales. Otros dos productos están en proceso de evaluación, mientras que dos más se espera que entren en revisión próximamente.
Necesidad urgente de diagnósticos en países con recursos limitados
La inclusión de estas pruebas en la lista de uso en emergencias cobra especial relevancia en África, donde la capacidad de diagnóstico es limitada y gran parte de los casos sospechosos de mpox no se han confirmado. En países como la República Democrática del Congo, a pesar de los esfuerzos de descentralización apoyados por la OMS, la tasa de diagnóstico confirmatorio sigue siendo baja, oscilando entre el 40% y el 50% de los casos sospechosos. La OMS, en colaboración con los fabricantes y las autoridades reguladoras de los países afectados, está trabajando para facilitar la aprobación y el registro nacional de estas pruebas, lo que contribuirá a mejorar el acceso a herramientas de diagnóstico de alta calidad.
El procedimiento de inclusión en la lista de uso en emergencias de la OMS permite que los productos médicos, como vacunas, tratamientos y pruebas diagnósticas, estén disponibles con mayor rapidez durante una emergencia de salud pública. Esta lista es una herramienta valiosa para las Naciones Unidas, sus organismos asociados y los Estados Miembros, ya que les ayuda en la toma de decisiones de adquisición a nivel internacional, regional y nacional.
Sin embargo, la inclusión en esta lista requiere que los fabricantes continúen generando datos adicionales para cumplir con los requisitos de precalificación. Esta precalificación es un proceso más exhaustivo, orientado a garantizar que los productos sigan cumpliendo con altos estándares de calidad y seguridad más allá de la situación de emergencia. De esta manera, la OMS asegura que los productos utilizados en emergencias puedan ser adoptados de forma permanente, brindando una solución sostenible para la detección y tratamiento de enfermedades.