El Ministerio de Salud emitió el borrador de la Resolución por la cual se definirían los perfiles ocupacionales del Talento Humano en Salud que serán beneficiarios del reconocimiento económico por una única vez, por su exposición al Covid-19 y la proporción del promedio del Ingreso Base de Cotización – IBC – por ocupación, con el fin de determinar el valor a reconocer y el mecanismo de giro por parte de la ADRES.
Perfiles que serán beneficiarios
Serán beneficiarios del reconocimiento económico por exposición al Covid-19, por una única vez, los perfiles
ocupacionales del Talento Humano en Salud, descritos en la siguiente tabla:
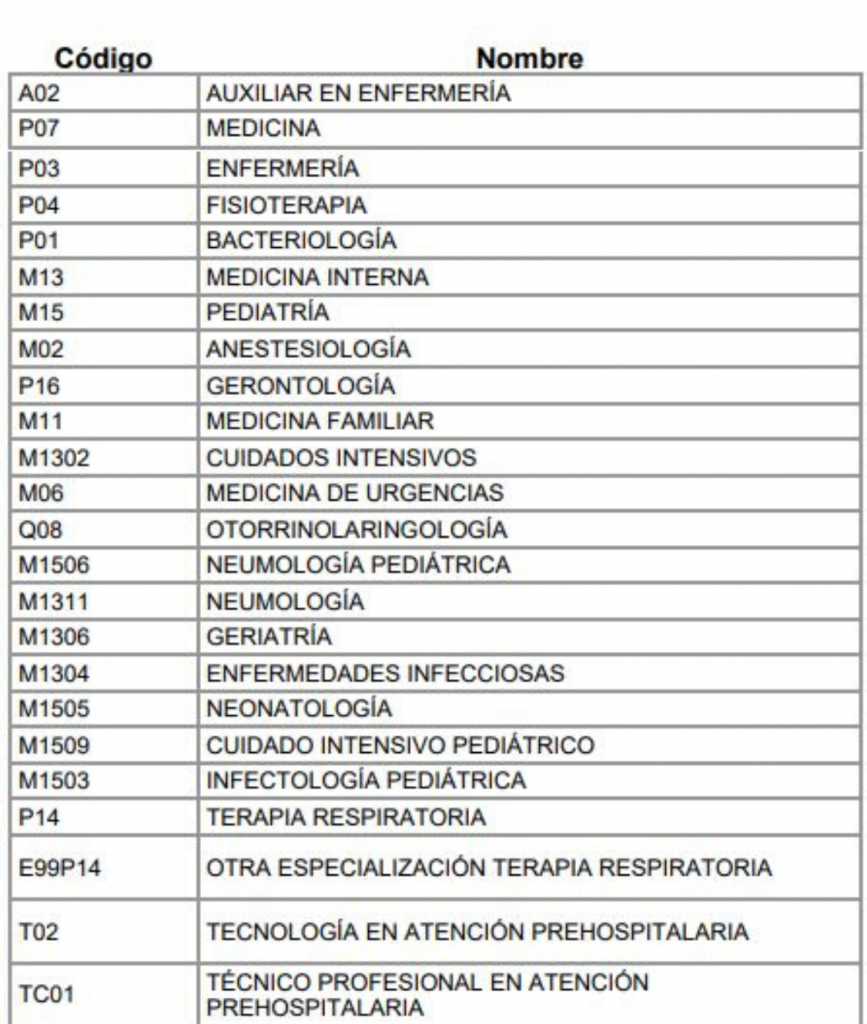
Cabe resaltar, que los perfiles ocupacionales beneficiarios del incentivo económico deberán encontrarse autorizados para ejercer en el territorio colombiano, inscritos en el Registro Único Nacional de Talento Humano en Salud – ReTHUS.
Deben además, prestar sus servicios durante la emergencia a pacientes con sospecha o diagnóstico de Coronavirus COVID19, en alguno de los servicios habilitados a los Prestadores de Servicios de Salud, relacionados con la atención domiciliaria, urgencias, consulta externa, traslado de
pacientes, hospitalización, cuidado intermedio y/o en cuidado intensivo, laboratorio y ayudas diagnósticas, o desempeñar actividades de vigilancia epidemiológica vinculado
a una entidad territorial de salud o prestador.
Adicionalmente, serán beneficiarios del reconocimiento los siguientes perfiles, siempre y cuando se encuentren atendiendo a pacientes con sospecha o diagnóstico:
- Los profesionales en medicina, bacteriología, enfermería, y Odontología que se encuentren prestando el Servicio Social Obligatorio – SSO, que reporten los prestadores de servicios de salud.
- Los residentes de programas de especialización medico quirúrgica, de acuerdo con su perfil de pregrado inscrito en el ReTHUS, serán reportados por el prestador de servicios de salud donde esté realizando sus estudios de especialización, de acuerdo con el Convenio Docencia Servicio suscrito entre elprestador y la Institución de Educación Superior
Para hacer el reporte de estos profesionales de la salud, las IPS y entidades territoriales deberán remitir una certificación firmada por el representante legal donde se demuestre que dichos perfiles se encuentran atendiendo casos positivos o sospechosos de Covid-19.
Es preciso decir, que el reconocimiento se pagará de acuerdo con el perfil reportado por la IPS o Entidad Territorial, siempre y cuando coincida con el reportado en el ReTHUS, en la fecha de corte de liquidación del incentivo.
Cuando el talento humano en salud presente dos o más perfiles reportados por la IPS o la ET y estos estén debidamente registrados en el ReTHUS, se reconocerá el incentivo por el de mayor valor. En todo caso, solo se realizará un único pago por profesional de la salud
En caso de que no coincida el perfil reportado por la IPS o la entidad territorial con lo reportado en el ReTHUS, el reconocimiento será calculado tomando como base lo reportado en el ReTHUS.
Cálculo del IBC para el pago del reconocimiento económico
A partir de la información de la Planilla Integrada de Aportes Laborales, se calculará un IBC promedio por cada uno de los perfiles del talento humano en salud beneficiarios del incentivo económico. El valor final a reconocer al talento humano en salud que cumpla con los requisitos establecidos será del 50% del IBC promedio calculado.
Sin embargo, el reconocimiento de estos valores por parte de la ADRES estará sujeta a la disponibilidad de los recursos.
Validación de los reportes de talento humano en salud
La ADRES, validará la información del talento humano en salud reportada por las Entidades Territoriales y las IPS públicas, privadas y mixtas, con la información del ReTHUS -, la base de datos de Servicio Social Obligatorio – SSO -, y con la Planilla Integrada de Liquidación de Aportes – PILA -; con el objetivo de validar, el perfil profesional del talento humano
potencial beneficiario de la medida, así como el estado activo en el ejercicio de sus competencias laborales y profesionales y el IBC promedio, para lo cual el Ministerio de Salud y Protección Social dispondrá la información necesaria
Esta validación del reporte de las IPS, se hará con la información reportada por el Sistema de Información SEGCOVID y RIPS.
Mientras que la validación de los profesionales que están prestando su servicio social Obligatorio será validad por la misma ADRES teniendo en cuenta la asignación de plazas realizadas por el Ministerio de Salud.
Reconocimiento y trámite de giro por parte de la ADRES
La ADRES será la entidad encargada de llevar a cabo el proceso de validación, liquidación, reconocimiento y pago del incentivo económico temporal al talento humano en salud
que preste sus servicios durante periodo de afectación por el Coronavirus – Covid 19, teniendo en cuenta los criterios establecidos en el presente acto administrativo, para lo
cual expedirá los procedimientos que deberán llevar a cabo las IPS y las Entidades Territoriales.
Finalmente, las fechas de reconocimiento y giro del incentivo económico temporal serán definidas por el Ministerio de Salud y Protección Social en atención a la evolución de la pandemia por coronavirus COVID-19.
También puede leer: Iniciativa global para garantizar la gratuidad de la vacuna contra el Covid-19


































