El Ministerio de Salud publicó la que será la circular 012 de 2021 con la que se unifica y se adiciona el listado de los medicamentos sujetos al régimen de control directo de precios y se fija su Precio Máximo de Venta, además de emitir nuevas directrices relacionadas con la regulación de precios de medicamentos Vitales No Disponibles.
Históricos de regulación de precios de medicamentos
Recordemos que la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos –CNPMDM expidió la Circular 03 de 2013, mediante la cual se estableció la metodología para la aplicación del régimen de control directo de precios para los medicamentos que se comercialicen en el territorio nacional.
A lo largo de los siguientes años se han venido publicando circulares reglamentarias y adiciones a este marco regulatorio, que además mantiene en ascuas al país entero, pues existe un borrador de circular que se terminó de discutir a finales del 2019, y que modificaría completamente la metodología de regulación de precios de medicamentos.
Recientemente se emitió por parte de la CNPMDM la circular 010 del 2020 con la que se adicionaron nuevos medicamentos a la lista y se actualizó el precio de otros teniendo en cuenta el IPC pero siguiendo la metodología de la norma del 2013, y la Circular 011 de 2020 por la cual se modifica parcialmente la Circular 10 de 2020. (Diario Oficial No. 51.274 del 01 de abril de 2020)
CIRCULAR 012 DE 2021 – PROYECTO
Los medicamentos sometidos al proceso de referenciación internacional en el segundo semestre de año 2020 se encuentran divididos en dos categorías: Medicamentos nuevos que se incluyen por primera vez al régimen de control directo, y Medicamentos Vitales No Disponibles.
Adicionalmente, el documento refiere que los Medicamentos Vitales No Disponibles se seleccionaron con base en la información suministrada por la ADRES y señala que el Precio Máximo de Venta de medicamentos regulados en anteriores circulares de la Comisión no fueron actualizados por IPC teniendo en cuenta la inflación acumulada entre abril 2020 y diciembre 2020 del -0.21%.
45 MERCADOS RELEVANTES NUEVOS A REGULACION DIRECTA DE PRECIOS
A raíz del brote del SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2, por sus siglas en ingles) en el país, las tres entidades que conforman la Comisión han sumado sus capacidades y esfuerzos a lo largo del presente año para hacerle frente a los retos que conllevan dicha situación, en el marco de sus competencias.
Bajo este contexto y teniendo en cuenta las fuertes presiones que la Emergencia Sanitaria ha generado sobre el SGSSS en su conjunto, esta Comisión priorizó la lista de los 45 mercados relevantes de medicamentos que están presentando mayor impacto financiero y que no habían sido sometidos a la metodología establecida en la Circular 03 de 2013 conforme a las capacidades operativas y la multiplicidad de tareas de estas entidades alrededor del curso de esta enfermedad en Colombia.
Incorporación de medicamentos a control directo
Se incorporan al régimen de control directo de precios 88 medicamentos este año, mientras que en el 2020 se sumaron a la lista 770 fármacos. El Precio Máximo de Venta establecido de estos medicamentos contempla los factores de ajuste que corresponde al promedio observado en los países de referencia entre el punto ex fábrica y el punto mayorista, y es del 6,10%. (el año pasado este porcentaje se ubicó en 7.05%)
También puede leer: Se mantiene recomendación para vacunas que lleguen través del COVAX
Precio Máximo de Venta de medicamentos regulados en anteriores circulares de la Comisión
Esta circular establece el Precio Máximo de Venta de medicamentos contenidos en anteriores circulares de la Comisión, y cuyo precio no fue actualizado mediante un nuevo ejercicio de referenciación en la presente Circular. Para este año se fija el precio máximo de venta de 2.492 medicamentos, mientras que en 2020 se instauró el precio máximo de venta de 1.717 fármacos.
Precio por unidad de regulación de Mercados Relevantes
El precio por unidad de regulación para todos los Mercados Relevantes o subconjuntos de estos, que a la fecha han sido sometidos a la metodología de la Circular 03 de 2013, se establecen en la tabla del presente artículo (529 medicamentos). Estos constituyen un Precio Máximo de Venta para las operaciones realizadas en las transacciones institucionales o con recursos públicos.
Para aquellos medicamentos que se encuentran financiados con recursos de la Unidad de Pago por Capitación – UPC sin indicaciones condicionadas, los precios establecidos sólo corresponden a un precio de referencia para el mercado.
Los precios de presentaciones comerciales no mencionadas, al igual que las nuevas presentaciones comerciales de medicamentos que conforman Mercados Relevantes regulados deben acogerse a lo previsto en esta norma.
Precio por unidad de regulación de Medicamentos Vitales No Disponibles.
El Precio Máximo de Venta por unidad de regulación de los siguientes Medicamentos Vitales No Disponibles para las operaciones realizadas con recursos asignados a la salud, es el siguiente:
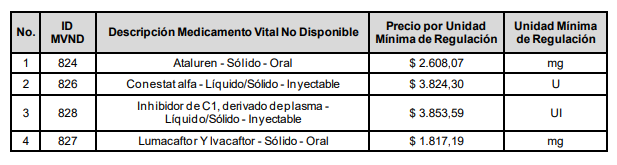
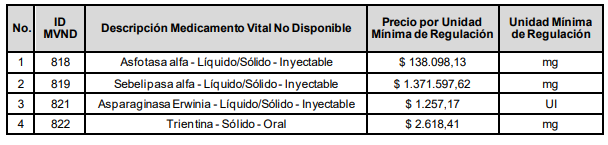
También se establece el Precio Máximo de Venta por unidad de regulación de Medicamentos Vitales No Disponibles contenidos en anteriores circulares de la Comisión, y cuyo precio no fue actualizado mediante un nuevo ejercicio de referenciación en la presente Circular:
Margen adicional para las IPS
Las Instituciones Prestadoras de Servicios de Salud podrán ajustar el precio regulado en los artículos 1, 3, 4, 5, 6 y 7 de esta circular, de la siguiente manera:
- Para las presentaciones comerciales con Precio Máximo de Venta menor o igual a $1.000.000, podrán adicionar un porcentaje hasta del 7%.
- Para las presentaciones comerciales con Precio Máximo de Venta mayor a $1.000.000, podrán adicionar un porcentaje hasta del 3.5%.
Cabe resaltar, que este margen es exclusivamente para reconocer el valor que las IPS agregan a la cadena de distribución de los medicamentos.
La Comisión observará el comportamiento de los precios de los medicamentos regulados y adoptará, en el marco de sus competencias, las medidas que sean del caso, con el fin de asegurar que, de adicionarse, se haga exclusivamente por parte de las IPS.
Finalmente, la circular explica que si la descripción de la forma farmacéutica de un Mercado Relevante es “sólido – oral” y no existe un Mercado Relevante adicional con el mismo principio activo y una forma farmacéutica “sólido – oral de liberación modificada”, se entenderá que el precio para el Mercado Relevante con forma farmacéutica “sólido – oral” aplicará para todas las presentaciones con esta última
forma farmacéutica, independientemente de que modifique o no la liberación del fármaco












































