Según el documento preliminar del Ministerio de Salud (MINSALUD), en el análisis de impacto normativo se evidencia como problema principal la debilidad en las condiciones de fabricación que permitan que los dispositivos médicos (DM) y reactivos de diagnóstico in vitro (RDIV) reúnan las características de calidad, seguridad y desempeño requeridas.
En la constitución, el Estado tiene la obligación de regular la calidad de los bienes y servicios ofrecidos a los ciudadanos, por lo que quienes los adquieren deben estar protegidos de sufrir algún detrimento en su salud. Este es el motivo por lo cual, los decretos 4725 de 2005 y 3770 de 2004 establecen el marco regulatorio para DM y RDIV, no obstante, estos no contemplan como obligatoriedad el establecimiento de las BPM. Es de señalar que tampoco existe un reglamento técnico que un fabricante nacional o internacional deba cumplir, y a la fecha no existe claridad sobre la aceptación u homologación de certificados equivalentes.
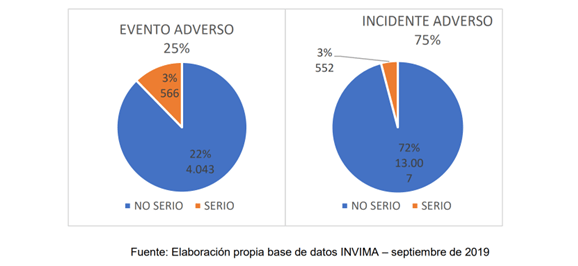
Menciona el documento que en relación con los dispositivos médicos “se puede mencionar que en la información del Programa de Tecnovigilancia recolectada en el contexto nacional entre los años 2015 y 2019, se evidencia que le fueron notificados al INVIMA 53.391 reportes, de los cuales 18.168 (33.7%) tienen un origen asociado a la fabricación. De estos últimos, el 75% corresponde a incidentes de DM y 25% a eventos de DM, situación que evidencia que, en dicho periodo de tiempo, 4.609 pacientes fueron afectados por razones asociadas a la fabricación de DM”
Le puede interesar: Modernización del PAI: sometido a discusión en la Comisión Séptima del Senado
De acuerdo con los datos recolectados por INVIMA, se reflejan falencias de adaptabilidad en las normas de producción y unos lineamientos poco eficaces para la verificación de calidad en los dispositivos médicos (DM) y los reactivos de diagnóstico in vitro (RDIV). Con el fin de solventar estos problemas, el Ministerio de Salud desarrolló una reglamentación de los requisitos para la obtención del certificado de capacidad de almacenamiento y/o acondicionamiento (CCAA), la resolución 132 de 2006 para los RIDV importados y la resolución 4002 para DM y RDIV. Por medio de estas resoluciones se diferencian los registros sanitarios (RS) para los productos importados
Existen aproximadamente 16.350 registros sanitarios para dispositivos médicos y 3.800 para reactivos de diagnóstico in vitro acorde a las bases de datos del INVIMA. De estos registros, el 7,8% de los fabricantes de DM son nacionales, mientras que el 91,2% restante son importados. Distribución similar en el caso de los RDIV donde el 3% son de fabricación nacional y el 97% son importados.
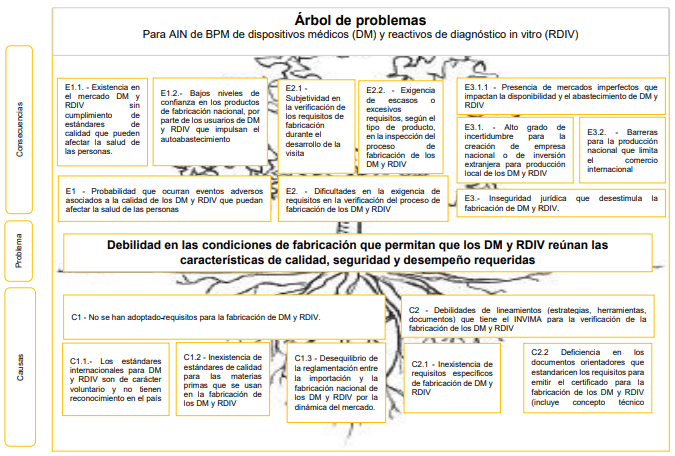
En la siguiente imagen 001 puede revisarse el árbol de problemas encontrado por el Minsalud:
No olvides leer: Actores sectoriales rediseñan estrategias para superar el desabastecimiento de medicamentos
Causas principales del problema
Se describen dos causas principales a saber:
- No se han adoptado los registros para la fabricación de DM y RDIV, y
- Existen debilidades en los lineamientos (estrategias, herramientas, documentos) que tiene el INVIMA para la verificación de la fabricación de los DM y RDIV
La complejidad de estas causas pasa por comprender con relación al numeral (1) que los estándares internacionales para dispositivos médicos y RDIV son de carácter voluntario y no tienen reconocimiento en el país, hay inexistencia de estándares de calidad para las materias primas que se usan en la fabricación de los DM y RDIV, también Desequilibrio de la reglamentación entre la importación y la fabricación nacional de los DM y RDIV por la dinámica del mercado.
Con relación al numeral (2) la inexistencia de requisitos específicos de fabricación de DM y RDIV y la deficiencia en los documentos orientadores que estandaricen los requisitos para emitir el certificado para la fabricación de los DM y RDIV.
Efectos del problema en los DM y RDIV
Los efectos mas notables son la existencia en el mercado de dispositivos médicos y RDIV sin cumplimiento de estándares de calidad que pueden afectar la salud de las personas, los bajos niveles de confianza en los productos de fabricación nacional, por parte de los usuarios de DM y RDIV que impulsan en el autoabastecimiento, la subjetividad en la verificación de los requisitos de fabricación durante el desarrollo de la visita, la exigencia de escasos o excesivos requisitos, según el tipo de producto, en la inspección del proceso de fabricación de los DM y RDIV, y la Inseguridad jurídica que desestimula la fabricación de DM y RDIV, entre otros.
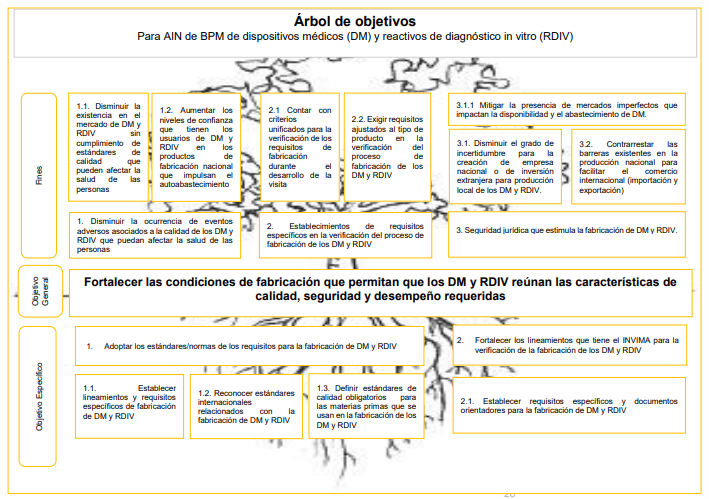
Objetivo general de la mejora pretendida sobre los dispositivos médicos y reactivos de diagnóstico in vitro
será el de fortalecer las condiciones de fabricación que permitan que los DM y RDIV reúnan las características de calidad, seguridad y desempeño requeridas
La imagen 002 compila de manera precisa el árbol de los objetivos trazados:
Descargue el documento: “AIN BPM DM+RDIV VERSIÓN DE PUBLICACIÓN JULIO 12 DEL 2022”