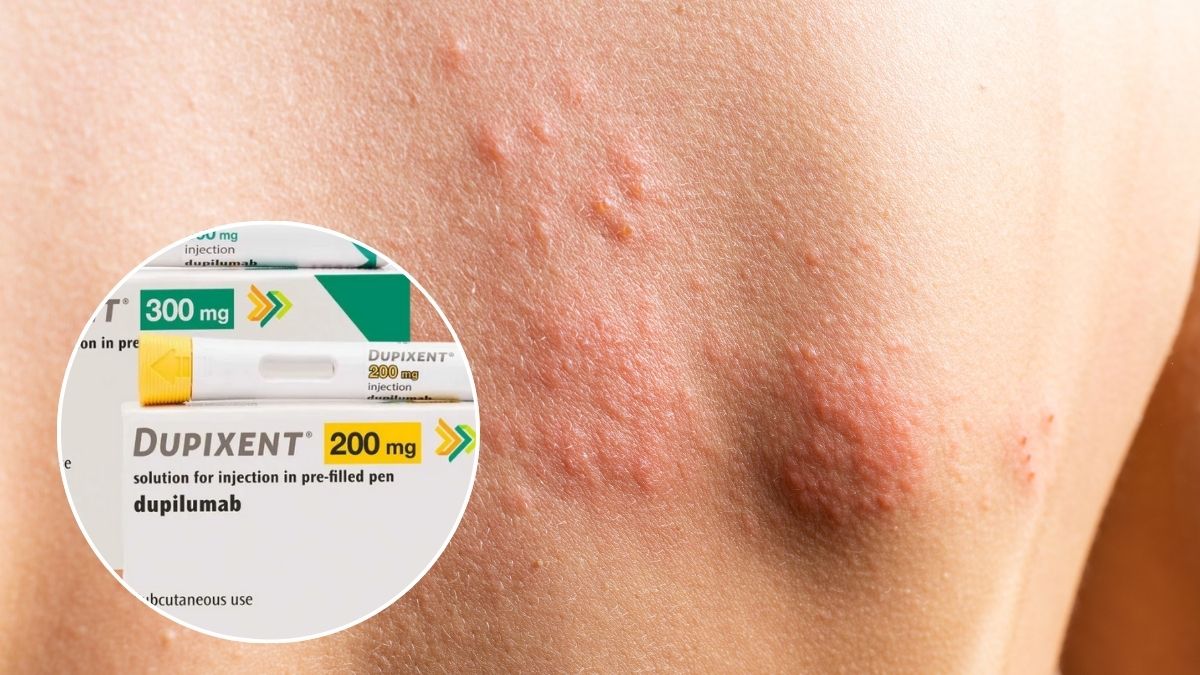
La urticaria crónica espontánea (UCE) es una condición dermatológica caracterizada por la aparición persistente de ronchas y picazón sin un desencadenante ambiental claro. Puede durar semanas, meses o incluso años, afectando severamente la calidad de vida de los pacientes. Aunque se dispone de tratamientos como antihistamínicos y el biológico omalizumab (Xolair), un grupo significativo de pacientes no responde adecuadamente o debe esperar semanas para notar mejoría.
El desarrollo de nuevas terapias para esta condición ha cobrado relevancia en la investigación farmacéutica, con compañías como Sanofi, Regeneron, Novartis, Celldex Therapeutics y Jasper Therapeutics impulsando alternativas biotecnológicas de última generación.
Aprobación de Dupixent en EE. UU.: un hito clínico tras obstáculos regulatorios
El fármaco Dupixent (dupilumab), una terapia biológica desarrollada por Sanofi y Regeneron, ha recibido finalmente la aprobación de la FDA para el tratamiento de la urticaria crónica espontánea, convirtiéndose en el primer nuevo tratamiento dirigido aprobado en más de 10 años para esta patología.
Este logro llega después de una ruta clínica y regulatoria compleja. En 2022, uno de los ensayos clave del fármaco no alcanzó su objetivo principal. En 2023, la FDA rechazó la solicitud inicial, solicitando datos adicionales sobre su eficacia.
Sin embargo, en 2024, las farmacéuticas presentaron nuevos resultados del ensayo Liberty-Cupid C, en el que se evaluó a pacientes con síntomas de urticaria no controlados pese al uso de antihistamínicos. Los resultados mostraron que añadir Dupixent al tratamiento estándar redujo en casi un 50% las puntuaciones de picazón y urticaria, en comparación con el grupo placebo. Esta evidencia fue suficiente para que la FDA concediera la aprobación en abril de 2025.
Séptima indicación para un biológico en expansión
Con esta aprobación, Dupixent alcanza su séptima indicación aprobada por la FDA, consolidando su papel como uno de los biológicos con mayor versatilidad terapéutica en enfermedades inflamatorias de base inmunológica.
En palabras de George Yancopoulos, director científico de Regeneron:
“Dupixent es el primer tratamiento nuevo y dirigido para la urticaria crónica espontánea en más de diez años, con ensayos fundamentales que demuestran su capacidad para reducir significativamente los síntomas característicos de picazón intensa y urticaria impredecible”.
¿Qué tan competitivo será Dupixent frente a otros candidatos?
A pesar del respaldo clínico y regulatorio, algunos analistas del sector farmacéutico mantienen reservas sobre el potencial comercial de Dupixent en esta nueva indicación. En un informe de 2023, Cantor Fitzgerald calificó los resultados del fármaco como “decepcionantes” frente a los datos presentados por Celldex Therapeutics, cuyo anticuerpo anti-KIT se perfila como una opción altamente eficaz.
Asimismo, en marzo de 2025, el banco de inversión Jefferies indicó que, tras consultar a especialistas en dermatología, Dupixent no parecía representar un “factor determinante” frente a otros agentes emergentes. Este escepticismo refleja la creciente competencia en un mercado en el que las diferencias de eficacia, velocidad de respuesta, y perfil de seguridad serán determinantes para el posicionamiento clínico y comercial de cada molécula.
Presencia internacional y proyecciones regulatorias
Además de la reciente aprobación en Estados Unidos, Dupixent ya cuenta con autorización para el tratamiento de la urticaria crónica en Japón, Brasil y Emiratos Árabes Unidos. Actualmente, se encuentra en revisión regulatoria en la Unión Europea y otros mercados clave, lo que podría ampliar significativamente su alcance global si logra replicar la evidencia presentada ante la FDA.
El producto generó casi 14.000 millones de dólares en ventas globales en 2024, lo que lo convierte en uno de los biológicos más exitosos del mercado. Su expansión terapéutica responde a una estrategia claramente dirigida a consolidar su liderazgo en el manejo de enfermedades inflamatorias de origen alérgico e inmunológico, como la dermatitis atópica, el asma severo y la rinosinusitis con poliposis nasal.