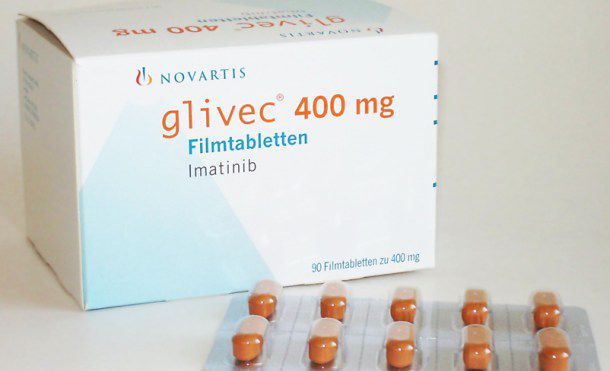
Con la Resolución 2475 de 2016, el Ministerio de Salud y Protección Social declara de interés público el medicamento Imatinib, por lo que le ordena a la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos fijar un nuevo precio al medicamento.
Al fijar este nuevo precio a Glivec, nombre comercial de Imatinib, se busca preservar el ahorro en el sistema de salud, a través de una metodología alternativa que simule óptimas condiciones de competencia.
Según un “Análisis de Mercado del Imatinib en Colombia” realizado en octubre de 2015, se evidencia que a pesar de que el Glivec es objeto de control directo del precio, la diferencia entre su precio y el del promedio de los medicamentos competidores que se venden en Colombia, es del 198%.
Este medicamento utilizado para el tratamiento de la leucemia mieloide crónica y otros tipos de cáncer, representa un costo anual por paciente que consume Glivec de $47.540.160, mientras que el mismo tratamiento usando el medicamento competidor más barato del mercado cuesta $9.234.720 (la diferencia es de $38.305.440 al año).
De acurdo con la Resolución 2475 de 2016, la metodología actual de referenciación internacional de precios contenida en la Circular 03 de 2013 de la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos, solo permite la referenciación por marca; en consecuencia, el precio controlado de Glivec en Colombia sólo refleja los precios de Glivec en otros países, y no permite capturar las eficiencias en el precio del mercado total de los medicamentos cuyo principio activo es el imatinib.
Después de la fallida de la negociación entre el Ministerio de Salud y Novartis, farmacéutica que cuenta con la patente del medicamento, de fijar un precio de $140 por miligramo al medicamento, el ministerio decidió fijar un nuevo precio mediante una metodología alternativa.
Sin embargo, la decisión está en la Superintendencia de Industria y Comercio quien debe hacer la declaratoria de licencia obligatoria, quien ha manifestado su renuencia al respecto.
Los recursos de reposición de la Resolución 2475 de 2016 se podrán hacer dentro de los diez (10) días siguientes de entrada en vigencia.
La Resolución 2475 de 2016 entra en vigencia a partir de su publicación
Descargue: Imatinib declarado de interés público – Resolución 2475 de 2016