Como auditor de servicios de salud y abogado especializado en los procesos indemnizatorios del Seguro Obligatorio de Accidentes de Tránsito – SOAT en Colombia, he acompañado a diversas Instituciones Prestadoras de Servicios de Salud (IPS) en el proceso de reclamación de servicios médicos derivados de accidentes de tránsito. Este proceso está regulado por una normativa específica que define los requisitos, coberturas y tarifas para acceder a la indemnización, principalmente integradas en el Decreto 780 de 2016 (Conocido como el Decreto Único del Sector Salud). No obstante, existen vacíos jurídicos importantes en el reconocimiento de ciertas tecnologías en salud, como medicamentos, insumos quirúrgicos y dispositivos médicos, cuyo valor no ha sido tarifado expresamente en la normativa SOAT. Tal es el caso del material de osteosíntesis (MAOS), amplia y frecuentemente utilizado en procedimientos quirúrgicos de ortopedia y traumatología.
La experiencia clínica y administrativa de las IPS revela que el tratamiento de lesiones osteomusculares es uno de los principales componentes en las atenciones cubiertas por el SOAT, especialmente por la alta frecuencia de accidentes en motociclistas y peatones. Las fracturas en extremidades requieren el uso de dispositivos médicos implantables, que suelen representar el ítem más costoso dentro de la atención quirúrgica. Sin embargo, estos materiales no cuentan con una regulación de precios ni un sistema de homologación técnica oficial, lo cual genera una enorme controversia en el proceso de reclamación y pago.
Desde el punto de vista práctico, la inexistencia de un manual tarifario ha generado que algunas aseguradoras objeten parcial o totalmente las reclamaciones, aduciendo sobrecostos sin respetar la obligación de pago de Material no sujeto a regulación de precios, sin aportar estudios técnicos comparativos adecuados, ni respetar la autonomía médica juzgando la pertinencia en el uso, tipo, aleación y fabricación de dichos dispositivos. A esto se suma que muchas IPS, para protegerse de objeciones sistemáticas y cumplir con la demanda de atenciones médico-quirúrgicas que requieren el suministro de MAOS, han optado por crear canales directos de adquisición o incluso por integrar verticalmente la cadena de distribución de MAOS, generando intermediación entre el fabricante y prestador, lo que también ha sido utilizado como argumento por las aseguradoras para presuponer conflicto de interés o abuso en la facturación, entre otras causales.
Esta problemática no es exclusiva del SOAT, sino que también se presenta en los regímenes subsidiado y contributivo. En todos los casos, el Estado carece de un sistema de vigilancia efectivo sobre la calidad, comercialización, trazabilidad y precio de los dispositivos implantables. Existen múltiples marcas, calidades y sistemas, pero no hay una codificación nacional que permita comparar materiales equivalentes.
Frente a esta situación, el Gobierno Nacional, a través del Ministerio de Salud y Protección Social, ha venido desarrollando el proyecto de estandarización semántica y de nomenclatura de dispositivos médicos, como parte de una política de transparencia, interoperabilidad e información para la toma de decisiones. Este esfuerzo, reglamentado mediante la Resolución 1405 de 2022, busca estructurar una base de datos nacional en el sistema SISPRO, incorporando identificadores únicos como The Global Medical Device Nomenclature (GMDN) ((GMDN), 2025) y Unique Device Identification System (UDI) (US FOOD & DRUGS ADMINISTRATION FDA, 2025), así como atributos técnicos obligatorios.
Sin embargo, en las fases iniciales de este proceso se han priorizado otros tipos de dispositivos (reactivos in vitro, equipos biomédicos y consumibles), dejando pendiente el avance sobre los materiales implantables como el MAOS. Esto ha llevado a que las IPS continúen enfrentando objeciones arbitrarias, glosas sin fundamento técnico y decisiones indemnizatorias que vulneran el debido proceso, la autonomía médica y el principio de integralidad de la atención en salud.
Desde esta perspectiva, este artículo busca visibilizar el marco normativo actual, el impacto que esta situación tiene sobre las IPS y reflexionar sobre la necesidad urgente de regular el reconocimiento económico del MAOS en el marco del SOAT, y proponer soluciones jurídicas, administrativas y técnicas para cerrar este vacío normativo.
1. Algunas generalidades sobre los dispositivos médicos
Según el Decreto 4725 de 2005 y el ABC de Dispositivos Médicos del INVIMA, un dispositivo médico es cualquier instrumento, aparato, máquina, software o artículo similar usado en seres humanos, solo o en combinación, para diagnóstico, prevención, tratamiento, alivio o compensación de enfermedades o lesiones, de los cuales podemos evidenciar la siguiente tipología:
| Clasificación por tipo de Dispositivo Médico | ||
| Tipo de Dispositivo Médico | Descripción | Ejemplo |
| Dispositivo médico activo | Requiere energía eléctrica o no biológica para funcionar. | Electrobisturí, incubadora |
| Dispositivo médico activo terapéutico | Restaura funciones biológicas solo o en conjunto con otro DM. | Desfibrilador, incubadora |
| Dispositivo médico implantable | Implante quirúrgico de permanencia > 30 días. | Clavo intramedular, stent coronario |
| Dispositivo médico invasivo quirúrgico | Se introduce en el cuerpo a través de orificio natural. | Endoscopio |
| Dispositivo con superficie de contacto | Se adhiere a piel o mucosa. | Apósitos |
| Dispositivo de comunicación interna y externa | Contacta sangre, líquidos corporales, tejidos u órganos. | Catéter, malla quirúrgica |
| Dispositivo médico terminado | Listo para uso y en empaque final. | Jeringa empacada |
| Dispositivo médico sobre medidas | Diseñado específicamente para un solo paciente. | Prótesis ortopédica personalizada |
| Dispositivo destinado a investigación clínica | Prototipo en desarrollo sin registro sanitario. | Implante experimental |
| Equipo biomédico | Dispositivo funcional con sistemas eléctricos o electrónicos, destinado al uso en humanos. | Máquina de anestesia, monitor cardíaco |
1.1. Clasificación de riesgo de los dispositivos médicos
La regulación actual adoptó una clasificación internacional basada en niveles de riesgo (Clase I a Clase III), siguiendo el modelo GHTF (Global Harmonization Task Force), en la cual deben cumplir con los requisitos de seguridad y funcionamiento, establecidos por el fabricante y que les sean aplicables de acuerdo con la finalidad prevista. En la siguiente tabla se muestra la clasificación de los riesgos.
| Clase | Nivel de Riesgo | Definición normativa |
| I | Bajo | Dispositivos médicos de bajo riesgo, usualmente no invasivos, cuyo uso no representa un riesgo potencial significativo para el paciente. Son aquellos que no requieren una fuente externa de energía ni intervienen de forma directa o continua en funciones fisiológicas. Ejemplo: gasas, vendas, termómetros de mercurio. |
| IIa | Moderado | Dispositivos de riesgo moderado que pueden ser invasivos de corta duración, o no invasivos, pero que se conectan a un dispositivo activo de clase más alta o son utilizados para almacenar, canalizar o administrar líquidos corporales. Ejemplo: sondas, catéteres de uso temporal, jeringas. |
| IIb | Alto moderado | Dispositivos médicos de mayor complejidad, implantables o que tienen contacto prolongado con el organismo humano, utilizados para mantener funciones vitales o realizar intervenciones quirúrgicas de mediana complejidad. Ejemplo: implantes traumatológicos (material de osteosíntesis), marcapasos temporales, bombas de infusión. |
| III | Alto | Dispositivos médicos de alto riesgo, generalmente implantables permanentes o utilizados para sostener o reemplazar funciones fisiológicas vitales. Su uso implica un control riguroso, y requieren evidencia clínica sustancial de seguridad y eficacia. Ejemplo: prótesis de cadera, válvulas cardíacas, marcapasos definitivos. |
Como podemos inferir, el Material de Osteosíntesis (MAOS), siendo un implante ortopédico, está clasificado como dispositivo médico de riesgo Clase IIB, es decir, son dispositivos de alto riesgo. Por ello, están sujetos a controles especiales en su diseño y fabricación, para demostrar la seguridad y efectividad en su uso. Por tal razón, los dispositivos médicos y equipos biomédicos, que no sean de tecnología controlada Clase IIB o Clase III, están sujetos a Registro Sanitario de Control Previo y requieren cumplir los requisitos técnico-científicos y sanitarios, para obtener el registro sanitario que autoriza su producción, importación, exportación, procesamiento, envase, empaque, almacenamiento, expendio y comercialización.
1.2. Material de Osteosíntesis (MAOS)
Es el nombre común dado a los Dispositivos Médicos Activos Terapéuticos destinados a sostener, modificar, sustituir o restaurar funciones o estructuras biológicas en el contexto del tratamiento de una lesión o deficiencia ósea. Generalmente se utilizan en procedimientos quirúrgicos realizados para corregir fracturas que son reducidas y fijadas, de forma estable, por medio de la inserción de placas, clavos o tornillos, entre otros. Los MAOS se utilizan mediante Kits o Sistemas que permiten la adecuada implantación de los mismos.
- Kit: se compone de varios elementos médicos (dispositivos, materiales, suministros) que permiten determinadas combinaciones, para lograr un propósito específico. Sin embargo, no se requieren todos los componentes de un kit para llevar a cabo un propósito específico y cada componente puede realizar una función diferente por sí mismo. El kit completo es una colección de elementos, pero cada uno de estos elementos puede utilizarse como un dispositivo médico independiente. (Fuente: GMDN Term Development Team).
- Sistema: un sistema consta de interacciones múltiples y dispositivos médicos interdependientes, que forman un todo integrado para llevar a cabo un propósito específico. Es decir, un sistema reúne todos los componentes para llevar a cabo un propósito. (Fuente: GMDN Term Development Team).
En Colombia, el material de osteosíntesis constituye uno de los rubros más costosos en procedimientos quirúrgicos traumatológicos. Las IPS lo facturan en función del proveedor, la marca y el procedimiento. Sin embargo, hasta ahora no existe una regulación oficial de precios, como lo vamos a ver en el siguiente capitulo
2. Regulación de tarifas de materiales de osteosíntesis
La normativa para el SOAT está definida por un grupo especial de normas, por lo que en este articulo citare los conceptos específicos, relacionados con la indemnización del Material de Osteosíntesis, en las reclamaciones de los servicios de salud con cargo al SOAT.
2.1. Cobertura del material de osteosíntesis en SOAT.
Actualmente, la normativa para el proceso indemnizatorio del SOAT forma parte del Decreto Único del Sector Salud, Decreto 780 de 2016 y de la Resolución 1236 de 2023. El artículo 2.6.1.4.2.1 del Decreto 780 de 2016 establece la cobertura de los Servicios de Salud a que tienen derecho las víctimas de accidente de tránsito. Dentro del articulado, el numeral 4 hace referencia al suministro de dispositivos médicos, material médico-quirúrgico, osteosíntesis, órtesis y prótesis, entre otros.
2.2. Requisitos para el pago del Material de Osteosíntesis en SOAT.
El artículo 2.6.1.4.2.20 del Decreto 780 de 2016 relaciona los documentos que se exigen, para presentar la solicitud de pago de los servicios de salud. En tal sentido el numeral 4o dispone:
“Original de la factura o documento equivalente de la IPS que prestó el servicio, que debe contener, como mínimo, la información señalada en el artículo 2.6.1.4.3.7 del presente decreto.”
A su vez en el numeral 5.3, de la Resolución 1236 de 2023, se establece que se exige la factura del proveedor, así:
“ Cuando se reclame el valor del material de osteosíntesis, copia de la factura electrónica de venta y/o equivalente, expedida por el proveedor, ya que esta soportará las tarifas máximas a reconocer.”.
También, los artículos 2.6.1.4.3.5 y 2.6.1.4.3.6 exigen, como soportes necesarios para el pago al reclamante, que se aporte la epicrisis o resumen clínico de atención. De igual forma, la Resolución 1236 de 2023 del Ministerio de Salud y Protección Social, en los numerales 2 y 3 del artículo 6, exige al reclamante que adjunte otros documentos como prueba de la prestación de los servicios de salud (Ej.: descripción quirúrgica, cuando se realice un procedimiento quirúrgico, la historia clínica, registro de anestesia, la fórmula médica y el soporte de lectura o interpretación de paraclínicos, etc.). Documentos que debe anexar, siempre y cuando en ellos se establezca, según corresponda, la prestación del servicio o la entrega de la tecnología en salud reclamados y el nexo causal con el evento que genera la atención.
En concordancia con lo anterior, el artículo 2.6.1.4.3.4 del Decreto 780 de 2016 establece la prohibición, para las aseguradoras, de solicitar documentos adicionales a los establecidos en dicho decreto, o en la resolución emitida por el Ministerio de Salud y Protección Social para tramitar y pagar los servicios de salud, indemnizaciones y gastos.
2.3. Las tarifas a reconocer por los servicios de salud – MAOS
En relación a las tarifas de los servicios de salud prestados a las víctimas de accidentes de tránsito que deben presentar los PSS a las compañías de seguros autorizadas para expedir el SOAT, el Art. 10 del Decreto 56 de 2015 hoy integrado en el artículo 2.6.1.4.2.4 del Decreto 780 de 2016 indica que se aplicarán las tarifas establecidas en el Anexo Técnico 1 del citado decreto, como también a las reguladas mediante el régimen de control directo de precios establecido por el Ministerio de Salud y Protección Social; a excepción de las tecnologías en salud que no tenga asignada.
En tal sentido, los dispositivos médicos, materiales de osteosíntesis y materiales quirúrgicos que no están sujetos a regulación tarifaria, deben ser reconocidos o indemnizados a la tarifa que tenga definida la Institución Prestadora de Servicios de Salud, al no existir un catálogo para venta al público fijado por la autoridad competente en cumplimiento de lo establecido en el artículo 57 del Decreto 2423 de 1996, identificado como Anexo 1 del Decreto 780 de 2016 “ Manual de Tarifas del Sector salud”
ARTÍCULO 57: Los suministros de prótesis y ortesis, injertos, válvulas, catéteres y sondas, tubos de cualquier clase, máscaras, cánulas y electrodos, no reutilizables; algodón laminado, vendas (elásticas, de yeso o gasa), mallas, medias ortopédicas, equipos de presión venosa central, marcapasos, elementos ortopédicos (placas, tornillos, férulas, clavos, grapas); esponjas y bandas de silicón, sustitutos del plasma, bolsas colectoras de fluidos y otros elementos de uso médico distintos a los definidos en el Parágrafo 5 del Artículo 55, utilizados en la práctica de cualquier intervención o procedimiento médico-quirúrgico relacionado en el Capítulo III y en el manejo ambulatorio u hospitalario del paciente, siempre y cuando no se trate de un examen o procedimiento contenido en el Capítulo IV, se reconocerán hasta por el precio comercial de catálogo para venta al público fijado por la autoridad competente. Así mismo se reconocerán los insumos que específicamente se encuentran fuera del conjunto, y que son objeto de pago adicional sobre la tarifa fijada para el respectivo conjunto. Estos insumos específicos se encuentran anotados con cada canasta discriminada en los conjuntos integrales de atención que hacen parte integral de este Decreto.
3. Avances normativos frente a la regulación de precios de dispositivos médicos en Colombia
En los últimos años, Colombia ha experimentado un importante desarrollo normativo con el propósito de mejorar la trazabilidad, codificación, interoperabilidad y vigilancia sobre los dispositivos médicos, incluyendo aquellos de alto costo como el material de osteosíntesis, para lo cual se ha expedido la Resolución 1405 de 2022 (por medio de la cual se estructura e implementa el estándar semántico y la codificación para los dispositivos médicos de uso humano y reactivos de diagnóstico in vitro, 2022). Estos avances, más allá del control clínico y sanitario, también sientan bases regulatorias indirectas para el control de precios y la transparencia en el reconocimiento de estos insumos en los esquemas de aseguramiento, incluyendo el SOAT. (Consultar en: https://www.minsalud.gov.co/salud/MT/Paginas/estandarizacion-dispositivos-medicos.aspx)
3.1. Algunas normativas aplicables a la estandarización semántica de los dispositivos médicos en Colombia:
- Ley 1438 de 2011, art. 91, modificada por el Decreto-Ley 019 de 2012, art. 117: ordena desarrollar un sistema de codificación estandarizada para dispositivos médicos que hacen parte del Sistema General de Seguridad Social en Salud (SGSSS)
- Resolución 2981 de 2011: primera norma que estableció la codificación estandarizada de insumos y dispositivos médicos.
- Resolución 2535 de 2013: reglamentó etapas del estándar semántico y asignó al INVIMA y al SISPRO roles clave en la administración, interoperabilidad y supervisión.
- Resolución 1405 de 2022: actualmente en vigor, formaliza la implementación del estándar semántico y codificación para dispositivos médicos de uso humano y reactivos de diagnóstico in vitro
- Otras normas complementarias: Decreto 4725 de 2005, Decreto 3275 de 2009, Decreto 1030 de 2007 y Ley Estatutaria 1751 de 2015.
3.2. Resolución 1405 de 2022 – Ministerio de Salud y Protección Social
Esta resolución establece la estructura e implementación del estándar semántico y la codificación para los dispositivos médicos de uso humano y los reactivos de diagnóstico in vitro, con el fin de:
- Homogeneizar la denominación de los productos en el SGSSS.
- Superar la dispersión de nombres comerciales y códigos, que entorpecía la trazabilidad y vigilancia.
- Habilitar una base de datos nacional interoperable (SISPRO) para el cargue obligatorio de los productos, con plazos escalonados según el riesgo (Clase I a III)
Además, obliga a que todos los productos cuenten con codificación estandarizada (UDI-DI, GMDN), como prerrequisito para su comercialización y seguimiento.
A su vez, el Ministerio ha avanzado en la estructuración de las fases de análisis y diseño de la estandarización semántica y codificación de dispositivos médicos, dentro de las cuales se resalta:
- Fase de análisis: Contiene el contexto nacional e internacional de los dispositivos médicos y los modelos de nomenclatura. Adicionalmente, define el modelo conceptual del estándar semántico para dispositivos médicos, destacando cuatro atributos claves: disponibilidad, accesibilidad, idoneidad y asequibilidad, lo cual influye directamente en la forma como se adquieren, pagan y usan los dispositivos en el sistema de salud.
- También, resalta la necesidad de aplicar el estándar semántico desde la fase de diseño y adquisición del dispositivo, hasta su disposición final, integrando criterios de costo-efectividad y seguridad en salud pública. A sí mismo, clasifica los dispositivos según su naturaleza (consumibles, equipos biomédicos, sobre medida) y plantea su registro bajo estándares internacionales (GS1, GMDN, UDI)
- Fase de diseño: Contiene la propuesta de la nomenclatura internacional integrada a un modelo de datos nacional. Este análisis técnico y normativo complementa la Resolución 1405 al revisar:
- El contexto internacional de regulación de precios y riesgos (FDA, OMS, ANMAT, ANVISA).
- La clasificación del riesgo por categorías A (bajo riesgo) a D (alto riesgo), donde se incluye el material de osteosíntesis como Clase C (alto riesgo moderado).
- El impacto del uso inadecuado, sobrefacturación y prácticas colusorias en la adquisición de dispositivos, especialmente aquellos de alto costo como las endoprótesis y materiales de osteosíntesis, lo que motivó la estandarización como herramienta indirecta de control de precios
Esta estandarización busca adoptar referencias internacionales como la GMDN (Global Medical Device Nomenclature), y ajustarlas al contexto normativo, clínico, comercial y logístico del país.
3.3 Objetivo del estándar semántico
Su finalidad es permitir la identificación única, trazabilidad y codificación técnica y comercial de los dispositivos médicos, integrando atributos regulatorios (registro sanitario), clínicos (uso en salud) y comerciales (cadena de suministro). El estándar se fundamenta en garantizar el acceso, la calidad y la seguridad en el uso de tecnologías en salud, incluyendo consumibles, equipos biomédicos y dispositivos sobre medidas, entre otras.
3.4. Beneficios de la Interoperabilidad Semántica
- Facilita la transparencia en la contratación y adquisición por parte de las IPS.
- Mejora el control del gasto público y la vigilancia de los sobrecostos.
- Establece una base para la futura regulación de precios.
- Permite el cruce de datos clínicos y financieros, mejorando la gestión del riesgo en salud.
- Evita duplicidades, errores o ambigüedades en el reconocimiento de tecnologías como el material de osteosíntesis (MAOS)
Este estándar será incorporado al SISPRO, particularmente al Sistema de Información de Tecnologías en Salud (SITS), y se interoperará con plataformas como la STS (Servicios Terminológicos en Salud). Esta integración se alinea con el enfoque de gobierno digital, facilitando decisiones basadas en datos, y creando condiciones técnicas para futuras políticas públicas de control de precios, calidad e innovación tecnológica
En conclusión, estos desarrollos normativos han creado un marco sólido para el control técnico, clínico y económico de los dispositivos médicos en Colombia. Si bien aún no existe un catálogo público de precios unitarios obligatorios, la trazabilidad semántica y los atributos de codificación permiten avanzar en sistemas que en el futuro faciliten la vigilancia de precios, la lucha contra glosas arbitrarias por parte de aseguradoras, y el diseño de catálogos tarifarios oficiales, como ya ocurre con algunos medicamentos y la mayoría de los procedimientos.
4. Retos actuales para la estandarización semántica y de nomenclatura y definir la indemnización del MAOS.
Como hemos visto, desde el punto de vista normativo los requisitos de la reclamación del MAOS están determinados por los artículos 2.6.1.4.2.20 del Decreto 780 de 2016 para las Aseguradoras SOAT y el numeral 5.3 de la Resolución 1236 de 2023, para la ADRES.
Frente a las tarifas a indemnizar se claro que el valor a reconocer es el del valor de la factura del proveedor del Material de Osteosíntesis al no existir un catálogo o regulación de precios por parte de la entidad competente, en consecuencia, a lo definido en el Art. 10 del Decreto 56 de 2015 hoy integrado en el artículo 2.6.1.4.2.4 del Decreto 780 de 2016, que indica que se aplicarán las tarifas establecidas en el Anexo Técnico 1, es decir lo definido en el numeral 56 del mismo Anexo.
Sin embargo, es claro que algunas aseguradoras, en función al proceso de verificación para definir la indemnización, siguen lo ordenado en el artículo 2.6.1.4.3.10, del prenombrado Decreto 780 de 2016, que establece que las aseguradoras deben verificar:
“(…) la ocurrencia del hecho, la acreditación de la calidad de víctima o del beneficiario, según sea el caso, la cuantía de la reclamación, su presentación dentro del término a que refiere este decreto, y si esta ha sido o no reconocida y/o pagada con anterioridad”.
Ahora bien, es importante mencionar que la Circular número 015 de 2016 (Gestión de la Atención de Accidentes de Tránsito, 2016), emitida por la Superintendencia Nacional de Salud (SNS), en su numeral 2.1.7, da instrucciones a los prestadores de servicios de salud, para que incluyan temas específicos relacionados con el uso adecuado y racional de los recursos del Sistema Obligatorio de Salud, dentro de sus estrategias y actividades de información.
La Superintendencia Financiera de Colombia (Pruebas para acreditar siniestro, 2004) se ha referido específicamente a este tema, cuando afirma:
“En este orden, atendiendo la carga probatoria que recae en las instituciones de salud, en su condición de titulares de la acción de reclamación, esta Entidad encuentra viable que para el reconocimiento del material de osteosíntesis hasta por el precio comercial, la compañía de seguros solicite la comprobación del costo de adquisición, para cuyo efecto la factura del proveedor o de la casa ortopédica resulta un medio probatorio idóneo, sin perjuicio de que pueda ser suficiente aportar otro documento que dé certeza respecto del costo de ese material.”
“Desde la anterior perspectiva, no se trata de efectuar “promedios” con base en los costos de los materiales, sino de contar con el soporte conducente, pertinente e idóneo para acreditar, ante el asegurador, el valor de los materiales utilizados en la atención a la víctima del accidente de tránsito”.
Ahora bien, en su Boletín Jurídico No. 34, la Superintendencia Nacional de Salud (2015) se ha referido a este punto, al responder la pregunta abajo citada, en los siguientes términos:
- Superintendencia Nacional de Salud de Colombia. Boletín Jurídico No. 34, 20/04/2015, Imposición y solución de glosas, archivo entidades en liquidación, coberturas póliza SOAT, término de prescripción de las facturas de servicios de salud, prescripción reclamaciones ante aseguradoras e interrupción; suficiencia patrimonial IPS. https://www.supersalud.gov.co/es-co/normatividad/boletin-juridico, 2016.
“¿Una vez prestado el servicio de salud al asegurado o beneficiario del SOAT, puede la aseguradora objetar el precio de medicamentos y materiales de osteosíntesis utilizados en la prestación del servicio, los cuales no están regulados en cuanto a su precio; o en caso contrario, ¿cada aseguradora puede establecer a su criterio el precio para tales materiales?”
Respuesta.
En relación con este punto, frente al precio de los materiales de osteosíntesis, resulta pertinente señalar que el Decreto 2423 de 1996, mediante el cual se reguló todo lo relacionado con las tarifas aplicables a las actividades y procedimientos médicos, quirúrgicos y hospitalarios, suministrados en virtud de accidentes de tránsito, desastres naturales, atentados terroristas, eventos catastróficos, y en la atención inicial de urgencias de otra naturaleza, es la regulación normativa a la cual se debe acudir en caso de que las partes no lleguen a un acuerdo respecto al costo de los materiales médico-quirúrgicos requeridos para un determinado tratamiento o intervención médica; sin embargo, dicha disposición normativa no contempla el marco tarifario relacionado con el costo de los materiales utilizados en el procedimiento de osteosíntesis. Lo anterior, toda vez que, si bien el numeral 4 del artículo 195 del Decreto 663 de 1993 le reconoce a las entidades prestadoras de servicios de salud la titularidad de la acción para presentar la correspondiente reclamación por gastos médicos, quirúrgicos, farmacéuticos y hospitalarios ante las entidades aseguradoras, las tarifas que les corresponde facturar se deben ajustar a las acordadas o, en su defecto, a las fijadas en el Decreto 2423 de 1996.
Ahora bien, teniendo en cuenta que los precios de medicamentos y materiales de osteosíntesis no se encuentran incluidos en las tarifas establecidas en el Decreto 2423 de 1996, y en el entendido que la Superintendencia Nacional de Salud no es la entidad competente para pronunciarse respecto al precio de los medicamentos y materiales utilizados en el procedimiento de osteosíntesis, consideramos adecuado informar al peticionario lo siguiente:
i Con excepción de la competencia atribuida a otras autoridades, la Superintendencia de Industria y Comercio es la entidad administrativa que ejerce control y vigilancia en relación con el cumplimiento de las normas sobre control de precios, especulación indebida y acaparamiento (Art. 1, núm. 42, Decreto 4886 de 2011);
ii el Ministerio de Salud y Protección Social es el organismo encargado de establecer los mecanismos para adelantar negociaciones de precios de medicamentos, insumos y dispositivos médicos (Art 2, núm. 10, Decreto 4107 de 2011) y;
iii la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos tiene a su cargo la función de fijar y adoptar los lineamientos generales para la formulación y regulación de la política de precios de medicamentos y dispositivos médicos en el país (Art 3, núm. 1, Decreto 1071 de 2012).
Dado lo anterior, deberá el usuario elevar su consulta ante las entidades anteriormente referidas para que emitan un pronunciamiento de fondo al respecto, toda vez que esta Superintendencia carece de competencia para impartir directrices sobre la materia.
Código de Comercio Colombiano, en los artículos 1074, 1077, 1078 y 1079, establece lo siguiente:
Es importante recordar que, por disposiciones del Estatuto Orgánico del Sistema Financiero (Estatuto Orgánico del Sistema Financiero, 1993), el SOAT se rige por las disposiciones del Contrato de Seguro. En consecuencia, para el proceso indemnizatorio del Material de Osteosíntesis en SOAT, debemos tener en cuenta los siguientes artículos:
Artículo 1074.- Ocurrido el siniestro, el asegurado estará obligado a evitar su extensión y propagación, y a proveer al salvamento de las cosas aseguradas. El asegurador se hará cargo, dentro de las normas que regulan el importe de la indemnización, de los gastos razonables en que incurra el asegurado en cumplimiento de tales obligaciones.
Artículo 1077.- Corresponderá al asegurado demostrar la ocurrencia del siniestro, así como la cuantía de la pérdida, si fuere el caso. El asegurador deberá demostrar los hechos o circunstancias excluyentes de su responsabilidad.
Artículo 1078.- Si el asegurado o el beneficiario incumplieren las obligaciones que les corresponden en caso de siniestro, el asegurador solo podrá deducir de la indemnización el valor de los perjuicios que le cause dicho incumplimiento. La mala fe del asegurado o del beneficiario, en la reclamación o comprobación del derecho al pago de determinado siniestro, causará la pérdida de tal derecho.
Artículo 1079.- El asegurador no estará obligado a responder sino hasta concurrencia de la suma asegurada, sin perjuicio de lo dispuesto en el inciso segundo del Artículo 1074.
En tal sentido, en el marco del contrato de seguro en caso de siniestro, el asegurado tiene la obligación de evitar la extensión y propagación de este (artículo 1074 del Código de Comercio), obligación que corresponde en el presente caso al beneficiario, pues es este quien está en posibilidad de cumplirlas (artículo 1041 del Código de Comercio).
Si el beneficiario incumple con la obligación enunciada, el artículo 1078 del Código de Comercio establece las siguientes consecuencias:
- Faculta al asegurador para deducir de la indemnización los perjuicios que le cause dicho incumplimiento.
- Si hay mala fe se producirá la pérdida del derecho a la indemnización.
Cualquiera de los supuestos anteriores debe ser aprobado por el asegurador, motivo por el cual invocar la pérdida del derecho es una situación remota en la medida que requiere acreditar la mala fe de la IPS.
El Análisis de la reclamación mediante la aplicación de valores promedios del mercado.
Es importante tener en cuenta que para realizar un análisis de precios del MAOS, se deben tener en cuenta una cantidad de variables que tienen que ver con:
1. Intermediación y margen de distribuidor
La cadena de suministros en Colombia suele involucrar varios niveles: fabricante, importador, distribuidor y finalmente la IPS. Cada eslabón agrega su margen de ganancia, lo que puede incrementar el precio final en un alto porcentaje, comparado con el precio del fabricante.
2. Fabricante y marca
Existen fabricantes locales certificados (acero/titanio con ISO 9001) y marcas importadas reconocidas. Las importadas suelen tener precios significativamente más altos debido a costos de importación, márgenes de marca y posicionamiento.
3. Tipo de material y características técnicas
La calidad del material (acero o titanio), aleaciones especiales, tratamientos superficiales o tecnologías sofisticadas (como tornillos canulados) influyen directamente en el costo. A mayor complejidad técnica, mayor precio, incluso dentro de la misma familia de productos
4. Economías de escala y volumen de compra
Las IPS que compran en mayores volúmenes o directamente al fabricante pueden acceder a precios institucionales más bajos, mientras que compras pequeñas o en últimas millas suelen salir más caras; también resulta la oportunidad en el pago en un factor importante para determinar el precio final.
5. Falta de transparencia y estructura de costos
No existe un catálogo público ni un sistema obligatorio para la declaración de costos por parte de fabricantes o distribuidores. Esta opacidad dificulta comparar precios y estimar el “valor justo”, lo que alimenta la variabilidad.
Sin embargo, Las Aseguradoras buscan realizar el pago basados en promedios de materiales similares reclamados por diferentes prestadores, por lo que es importante, además de tener en cuenta lo anterior, seguir las metodologías de estandarización semántica adelantadas mundialmente.
Es importante mencionar que existen grandes limitantes para una completa estandarización semántica. Para el caso del SOAT, el soporte documental que aporta el beneficiario de la reclamación, para pretender el pago indemnizatorio, es la copia de la factura de venta del material de osteosíntesis que adquirió de un tercero, es decir, un proveedor o distribuidor de MAOS. En dicho título valor solamente se relacionan los códigos y descripciones internas, propias de cada proveedor, para identificar y facturar el material.
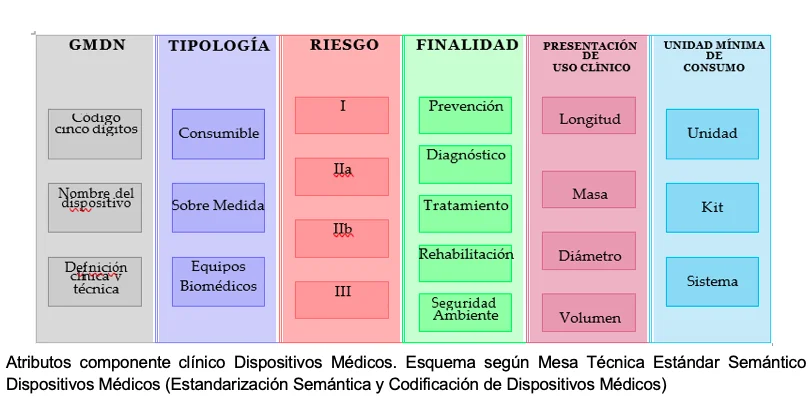
En Colombia no hay un estándar semántico y de nomenclatura de estos materiales. A nivel internacional, se conocen entidades privadas que realizan la codificación de diferentes dispositivos médicos, pero esta información es reservada para las organizaciones miembros. En consecuencia, si los pagadores usan una estandarización semántica y de nomenclatura propia, la misma debería estar guiada por los criterios expuestos en la etapa de análisis y diseño del proyecto del Ministerio de Salud de Colombia, basados en los atributos del componente clínico; Al no contar con la información de la GMDN ni con una tipología específica para identificar semánticamente cada MAOS, se utilizarán atributos clínicos parciales, como se observa en la Tabla.
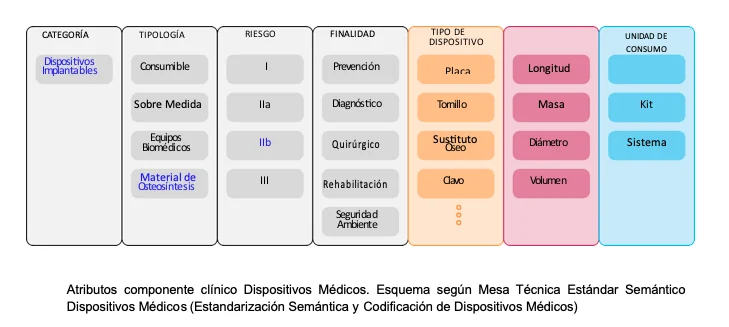
Al no contar con la información de la GMDN ni con una tipología específica para identificar semánticamente cada MAOS, se utilizarán atributos clínicos parciales, como se observa en la Tabla.
En conclusión, en virtud del análisis expuesto, resulta evidente que la variación en los precios del material de osteosíntesis (MAOS) en Colombia no obedece a una estructura uniforme o tarifada, sino que depende de múltiples factores legítimos como la cadena de intermediación, la marca del fabricante, la calidad técnica del material, el volumen de compra y la opacidad del mercado. Estas variables, que escapan al control de las IPS, deben ser reconocidas por las aseguradoras al momento de definir el valor indemnizatorio en el marco del SOAT.
En consecuencia, la aseguradora está obligada a indemnizar un precio justo, no con base en promedios arbitrarios de mercado, sino atendiendo a la normatividad vigente (Decreto 780 de 2016, Resolución 2284 de 2023, conceptos de Supersalud y Superfinanciera) y a los soportes aportados por el reclamante, especialmente la factura del proveedor, la historia clínica y la nota operatoria. La aplicación unilateral de valores de referencia sin criterios técnicos ni estandarización validada representa un desconocimiento de la autonomía médica, de la especificidad clínica de cada caso y de los principios que rigen el aseguramiento en salud.
Por tanto, ante la ausencia de un manual tarifario oficial o de una nomenclatura técnica obligatoria como la GMDN, se impone la necesidad de concertar con el reclamante un valor indemnizatorio razonable, sustentado en los atributos clínicos y comerciales del dispositivo utilizado. Esta aproximación es no solo legalmente procedente, sino necesaria para garantizar el equilibrio financiero, la transparencia en el sistema y la protección de los derechos de las víctimas de accidentes de tránsito y de las IPS que garantizan su atención.
Conclusiones
- El material de osteosíntesis debe ser reconocido dentro de la cobertura del SOAT, siempre que la IPS cumpla con los requisitos documentales exigidos por la normatividad vigente, principalmente: los soportes de la reclamación con la nota operatoria, la factura por la prestación del servicio y la factura del proveedor del MAOS.
- Las glosas por presunto “sobrecosto” carecen de sustento legal. La normativa (Decreto 780 de 2016) prohíbe expresamente exigir documentos adicionales no contemplados en el reglamento, y determina que el valor a reconocer en ausencia de tarifa oficial será el facturado por la IPS.
- No existe un manual tarifario oficial ni estudios técnicos consolidados que definan un “precio justo” o “promedio de mercado” para el MAOS, por lo cual las aseguradoras no pueden imponer valores de referencia propios sin un acuerdo previo con la IPS ni desconocer la autonomía médica del tratante.
La utilización del MAOS debe evaluarse conforme a criterios clínicos, quirúrgicos y contextuales, y no con base únicamente en codificaciones internas o listados de precios genéricos. Cada procedimiento tiene particularidades técnicas, anatómicas y de urgencia que justifican la elección y el valor del implante.
- En muchos casos, las aseguradoras omiten su deber de buena fe contractual, utilizando glosas sin argumentación técnica, sin proponer conciliación ni reconocer parcialmente la reclamación. Esta conducta puede constituir una posición dominante y abusiva, sancionable por las autoridades de control.
Recomendaciones para las IPS
- Radicar las reclamaciones con soportes completos
- En caso de objeción o glosa por sobrecosto, la IPS debe:
- Solicitar reconsideración formal, con argumentación médica y técnica.
- Exigir que la aseguradora sustente su glosa con normatividad específica y evidencia objetiva.
- Pedir agendamiento de reunión de conciliación, dejando constancia del incumplimiento si esta no se realiza.
- No aceptar de forma automática devoluciones ni glosas, sin revisión jurídica y médica interna. Estas deben ser evaluadas por el comité de conciliación de cartera y auditadas por el área jurídica.
- Invocar los principios legales aplicables ante autoridades de control (Supersalud, Superfinanciera), incluyendo:
- Buena fe contractual (art. 871 del Código de Comercio).
- Deber de indemnización del contrato de seguro (arts. 1077 y 1080 C. de C.).
- Prohibición de prácticas restrictivas o abusivas (Ley 100/93, Ley 1328/09).
- Solicitar la intervención de la Superintendencia Nacional de Salud cuando se presenten glosas masivas, negativas sistemáticas o incumplimientos al deber de conciliación. Se puede pedir apertura de investigación administrativa por uso de posición dominante en el mercado del SOAT.
- Acudir al proceso judicial en caso de ratificación injustificada del no pago del MAOS
Referencias
- (GMDN), T. G. (2025). https://www.gmdnagency.org/ . Obtenido de https://www.gmdnagency.org/
- Estandarización Semántica y Codificación de Dispositivos Médicos. Obtenido de https://www.minsalud.gov.co/salud/MT/Paginas/estandarizacion-dispositivos-medicos.aspx
- Estatuto Orgánico del Sistema Financiero (Presidencia del a Republica de Colombia 1993). Obtenido de https://www.funcionpublica.gov.co/eva/gestornormativo/norma.php?i=1348
- Gestión de la Atención de Accidentes de Tránsito, CIRCULAR EXTERNA 015 DE 2016 (2016). Obtenido de https://docs.supersalud.gov.co/PortalWeb/Comunicaciones/MemoriasEventos/abece-circular-externa-00015-de-2016.pdf
- por medio de la cual se estructura e implementa el estándar semántico y la codificación para los dispositivos médicos de uso humano y reactivos de diagnóstico in vitro, RESOLUCIÓN NÚMERO 1405 DE 2022 (MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL 2022). Obtenido de https://www.minsalud.gov.co/Normatividad_Nuevo/Resoluci%C3%B3n%20No.%201405%20de%202022.pdf
- Pruebas para acreditar siniestro, Concepto 2003064659-1 de 2004 (Superintendencia Bancaria de Colombia 2004). Obtenido de https://www.superfinanciera.gov.co/publicaciones/18967/historico-de-conceptos-18967/
- System, U. D. (2025). US FOOD & DRUGS ADMINISTRATION FDA. Obtenido de FDA: https://www.fda.gov/medical-devices/device-advice-comprehensive-regulatory-assistance/unique-device-identification-system-udi-system