- PUBLICADO:
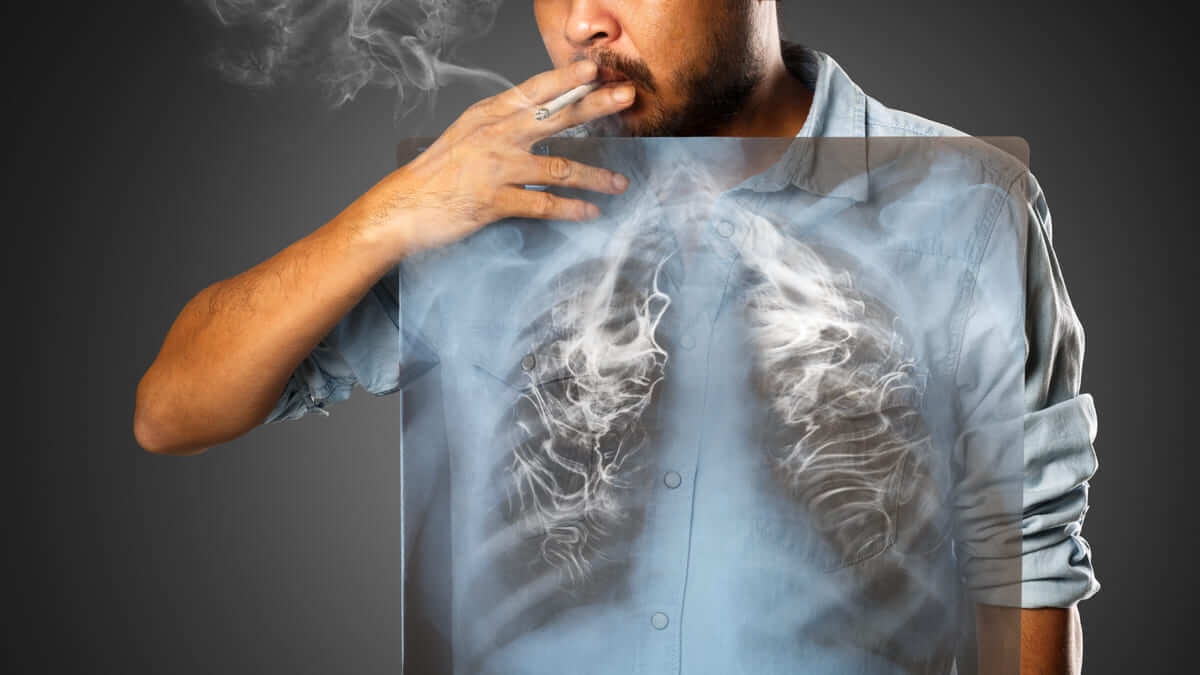
¿Cómo afecta el humo el ADN de las células pulmonares normales?
Escucha esta noticia
Cargando audio...
Las células sanas en los pulmones de los fumadores tienen una alta carga de mutaciones, similar al perfil mutacional del cáncer de pulmón. Sorprendentemente, los pulmones de los ex fumadores tienen una gran fracción de células sanas con perfiles casi normales.
Por: Gerd P. Pfeifer
NATURE
Traducción de ACHO de https://www.nature.com/articles/d41586-020-00165-7
Según la Organización Mundial de la Salud, hay 1.100 millones de fumadores en todo el mundo y un estimado de 1.8 millones de muertes por cáncer de pulmón anualmente. El cáncer de pulmón causado por fumar puede tardar décadas en surgir, y los fumadores tienen un riesgo hasta 30 veces mayor de desarrollar la enfermedad que los no fumadores. Los componentes cancerígenos del humo del tabaco promueven el cáncer de pulmón al causar daños en el ADN que pueden conducir a mutaciones a través de mecanismos conocidos, pero no se conocen bien las consecuencias iniciales del tabaquismo para las células pulmonares sanas. Escribiendo en Nature, Yoshida et al (1). reportan los perfiles mutacionales de 632 células pulmonares sanas obtenidas de la secuenciación del genoma completo de tejido biopsiado de 16 individuos: niños, adultos, no fumadores, fumadores actuales y exfumadores. Los autores analizaron la frecuencia y las propiedades de las mutaciones presentes, cómo diferían según la edad y el tabaquismo, y cómo estas mutaciones se relacionaban con las que se encuentran en un tipo de cáncer de pulmón llamado carcinoma de células escamosas.
Análisis del genoma de las células pulmonares de niños, adultos, no fumadores, fumadores actuales y exfumadores
Los autores disociaron las células del tejido pulmonar y aislaron un tipo de célula epitelial llamada célula basal (que puede renovarse por sí misma). El crecimiento de células individuales en colonias celulares permitió a los autores determinar la secuencia de ADN de la célula original dada. Una advertencia potencial del estudio es que, aunque los autores obtuvieron las secuencias del genoma de cientos de células individuales, el número de individuos con cada tabaquismo diferente fue relativamente pequeño. Los autores informan que el número de mutaciones de un solo nucleótido (punto) aumentó con la edad: por cada año adicional de vida, se encontraron alrededor de 22 mutaciones adicionales por célula.
Aumento dramático de las mutaciones en fumadores
Sin embargo, ser un ex fumador agregó otras 2,330, y ser un fumador actual agregó 5,300 puntos de mutaciones por celda en promedio, lo que confirma la potencia mutacional del tabaquismo. Los genomas de los fumadores también tenían ejemplos extensos de otros tipos de alteraciones, como las mutaciones de inserción o deleción. El número de mutaciones en diferentes células del mismo individuo podría variar diez veces en los fumadores, una variabilidad mucho mayor que la encontrada en los no fumadores. La etapa del ciclo celular en la que una célula está expuesta a agentes cancerígenos podría afectar la efectividad de la reparación del daño del ADN antes de la replicación del ADN, lo que podría ofrecer una explicación para esta alta variabilidad.
Firmas mutacionales en no fumadores, fumadores y exfumadores
Los autores informan que la presencia de ciertas firmas mutacionales aumentó con la edad y no pareció verse afectada por el tabaquismo. Estos incluyeron una firma atribuida a procesos naturales mediante los cuales la pérdida de un grupo amino en una citosina modificada (denominada 5-metilcitosina) cambia la base a una timina. La firma mutacional más común en todas las muestras fue rica en mutaciones de citosina a timina y de timina a citosina. La presencia de esta firma aumentó con la edad y fue más común en personas con antecedentes de tabaquismo. Los procesos subyacentes que impulsan estas mutaciones son desconocidos. La firma más común dependiente del tabaquismo consistió en mutaciones de guanina a timina, una firma que es característica de la mayoría de los cánceres de pulmón asociados con el tabaquismo.
También puede leer: Sobre Ganoderma, el método científico, y saberes ancestrales
Unas pocas mutaciones promotoras pueden desencadenar el cáncer
Los cánceres de pulmón tienen algunas de las frecuencias de mutación más altas de todos los tipos de tumores; sin embargo, se cree que solo una pequeña cantidad de mutaciones promotoras de tumores (impulsoras) deben ocurrir en una sola célula para iniciar el crecimiento maligno. Dada la alta carga mutacional y las firmas mutacionales específicas asociadas al tabaquismo que se encuentran en las células epiteliales sanas de los fumadores, Yoshida y sus colegas examinaron si estas mutaciones afectaban genes cruciales que son relevantes para el crecimiento del cáncer.
De hecho, encontraron células que habían adquirido mutaciones en genes, incluidos TP53 y NOTCH1, que son mutaciones impulsoras en carcinomas de células escamosas. Estas mutaciones conductoras fueron más comunes en las células pulmonares de los fumadores que en las de los no fumadores. Algunas células incluso tenían hasta tres mutaciones impulsoras. Sin embargo, no sabemos cuántas de estas mutaciones (y en qué combinación) son necesarias para que se desarrolle el cáncer de pulmón humano. Se encontraron mutaciones específicas de TP53 en múltiples células del mismo individuo, lo que sugiere que estas mutaciones ocurren temprano, que las células con la mutación proliferan, o ambas, similar a lo que se ha observado para la piel humana sana expuesta al sol.
La permanencia de las mutaciones promotoras pueden explicar el cáncer en los ex fumadores
El mayor riesgo de cáncer de pulmón en los ex fumadores en comparación con los no fumadores se refleja en su alta carga de mutación y la firma de mutaciones asociadas al tabaquismo en la mayoría de sus células pulmonares (similar al perfil celular de los fumadores actuales). Aunque los exfumadores tienen un alto riesgo de desarrollar cáncer de pulmón, su riesgo se reduce en comparación con el de los fumadores actuales, y esta disminución depende de la duración del tiempo para dejar de fumar. Por qué este es el caso ha sido difícil de explicar.
Las células de los ex fumadores tienden a normalizarse
Sin embargo, quizás el resultado más sorprendente del trabajo de Yoshida y sus colegas podría ofrecer una pista: en 5 de cada 6 exfumadores, del 20 al 50% de las células tenían una baja carga de mutación similar al perfil de los no fumadores de el mismo rango de edad.Estas células casi normales en ex fumadores tenían una baja frecuencia de firmas mutacionales dependientes del tabaquismo. Además, en comparación con las células altamente mutadas de los ex fumadores, estas células casi normales tenían versiones más largas de estructuras de ADN llamadas telómeros, que se encuentran en los extremos de los cromosomas. La longitud de los telómeros se acorta con cada división celular; así, los telómeros largos sugieren que estas células no habían sufrido muchas divisiones. Los autores especulan que estas células podrían haber surgido comparativamente recientemente de divisiones de células madre propuestas previamente inactivas (inactivas). Sin embargo, se desconoce si tales células existen en los pulmones humanos.
¿Existen las células madre en el pulmón?
El daño en el ADN puede generar una mutación durante la replicación del ADN. Por lo tanto, si existe una población de células madre que no se dividen en el pulmón humano, incluso si están expuestas a agentes cancerígenos, tal vez tales células podrían evitar incurrir en mutaciones si el daño del ADN finalmente se repara en ausencia de división. Pero la falta de conocimiento sobre estas células madre de larga vida propuestas y la información sobre la longevidad de los diferentes tipos de células en el pulmón humano dificultan la explicación de lo que ocurrió en estas células de exfumadores con pocas mutaciones.
¿Por qué los exfumadores aún tienen una fracción sustancial de células altamente mutadas que pueden proliferar, al menos cuando crecen in vitro? Cualquier célula de vida corta que haya estado expuesta a carcinógenos durante su proliferación debería haber desaparecido muchos años después de dejar de fumar. Esto plantea la cuestión de si hay células diferenciadas de larga duración en el pulmón que llevan una carga mutacional alta, y si estas células pueden reanudar la proliferación, tal vez debido a la plasticidad (la capacidad de cambiar la identidad celular) de las células pulmonares. Un desafío futuro será comprender la biología celular de los mecanismos subyacentes a estas observaciones. Quizás algún día sea posible desarrollar formas de aumentar la población de células pulmonares con pocas mutaciones en ex fumadores.
En conclusión
El estudio de Yoshida y sus colegas ha ampliado nuestra comprensión de los efectos del humo del tabaco en las células epiteliales normales del pulmón humano. Ha arrojado luz sobre cómo el efecto protector de dejar de fumar se desarrolla a nivel molecular en el tejido pulmonar humano y plantea muchas preguntas interesantes dignas de futuras investigaciones.
Referencia
- Yoshida, K. et al. Nature https://doi.org/10.1038/s41586-020-1961-1 (2020).























![{"type":"elementor","siteurl":"https://consultorsalud.com/wp-json/","elements":[{"id":"37e6683","elType":"widget","isInner":false,"isLocked":false,"settings":{"text":"IR AL CURSO","link":{"url":"https://formarsalud.com/cursos/estrategias-para-el-saneamiento-financiero-de-ips-en-crisis/","is_external":"","nofollow":"","custom_attributes":""},"align":"center","badge_text":"Badge","button_effect":"c","advanced_button_text_color":"#FFFFFF","button_background_background":"classic","button_border_style":"none","button_hover_background_background":"classic","button_hover_border_style":"none","wcm_element_visibility_content_restricted_message":"You are not authorized to view this content.","ep_widget_cf_colors":"#D30C5C, #0EBCDC, #EAED41, #ED5A78, #DF33DF","ep_display_conditions":[],"ep_parallax_effects_transition_for":"all","ep_parallax_effects_transition_duration":"100","ep_parallax_effects_transition_easing":"linear","__globals__":{"advanced_button_text_color":"","button_background_color":"globals/colors?id=3ab82b4d","button_hover_background_color":"globals/colors?id=50006a26"},"advanced_button_padding":{"unit":"px","top":"7","right":"20","bottom":"7","left":"20","isLinked":false},"advanced_button_padding_tablet":{"unit":"px","top":"7","right":"20","bottom":"7","left":"20","isLinked":false},"ep_widget_cf_shapes":"square|circle","ep_widget_cf_shapes_emoji":"🎃|🎄|💜","ep_widget_cf_shapes_svg":"M167 72c19,-38 37,-56 75,-56 42,0 76,33 76,75 0,76 -76,151 -151,227 -76,-76 -151,-151 -151,-227 0,-42 33,-75 75,-75 38,0 57,18 76,56z|M120 240c-41,14 -91,18 -120,1 29,-10 57,-22 81,-40 -18,2 -37,3 -55,-3 25,-14 48,-30 66,-51 -11,5 -26,8 -45,7 20,-14 40,-30 57,-49 -13,1 -26,2 -38,-1 18,-11 35,-25 51,-43 -13,3 -24,5 -35,6 21,-19 40,-41 53,-67 14,26 32,48 54,67 -11,-1 -23,-3 -35,-6 15,18 32,32 51,43 -13,3 -26,2 -38,1 17,19 36,35 56,49 -19,1 -33,-2 -45,-7 19,21 42,37 67,51 -19,6 -37,5 -56,3 25,18 53,30 82,40 -30,17 -79,13 -120,-1l0 41 -31 0 0 -41z|M449.4 142c-5 0-10 .3-15 1a183 183 0 0 0-66.9-19.1V87.5a17.5 17.5 0 1 0-35 0v36.4a183 183 0 0 0-67 19c-4.9-.6-9.9-1-14.8-1C170.3 142 105 219.6 105 315s65.3 173 145.7 173c5 0 10-.3 14.8-1a184.7 184.7 0 0 0 169 0c4.9.7 9.9 1 14.9 1 80.3 0 145.6-77.6 145.6-173s-65.3-173-145.7-173zm-220 138 27.4-40.4a11.6 11.6 0 0 1 16.4-2.7l54.7 40.3a11.3 11.3 0 0 1-7 20.3H239a11.3 11.3 0 0 1-9.6-17.5zM444 383.8l-43.7 17.5a17.7 17.7 0 0 1-13 0l-37.3-15-37.2 15a17.8 17.8 0 0 1-13 0L256 383.8a17.5 17.5 0 0 1 13-32.6l37.3 15 37.2-15c4.2-1.6 8.8-1.6 13 0l37.3 15 37.2-15a17.5 17.5 0 0 1 13 32.6zm17-86.3h-82a11.3 11.3 0 0 1-6.9-20.4l54.7-40.3a11.6 11.6 0 0 1 16.4 2.8l27.4 40.4a11.3 11.3 0 0 1-9.6 17.5z","add_custom_attributes":"","custom_attributes":"","button_size":"md","onclick":"","onclick_event":"","align_tablet":"","align_mobile":"","button_icon":{"value":"","library":""},"icon_align_choose":"center","icon_align":"right","icon_indent":{"unit":"px","size":8,"sizes":[]},"show_button_badge":"","badge_align":"right","badge_indent":{"unit":"px","size":8,"sizes":[]},"button_css_id":"","attention_button":"","button_background_gradient_notice":"","button_background_color":"","button_background_color_stop":{"unit":"%","size":0,"sizes":[]},"button_background_color_stop_tablet":{"unit":"%"},"button_background_color_stop_mobile":{"unit":"%"},"button_background_color_b":"#f2295b","button_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"button_background_color_b_stop_tablet":{"unit":"%"},"button_background_color_b_stop_mobile":{"unit":"%"},"button_background_gradient_type":"linear","button_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"button_background_gradient_angle_tablet":{"unit":"deg"},"button_background_gradient_angle_mobile":{"unit":"deg"},"button_background_gradient_position":"center center","button_background_image":{"url":"","id":"","size":""},"button_background_image_tablet":{"url":"","id":"","size":""},"button_background_image_mobile":{"url":"","id":"","size":""},"button_background_position":"","button_background_position_tablet":"","button_background_position_mobile":"","button_background_xpos":{"unit":"px","size":0,"sizes":[]},"button_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"button_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"button_background_ypos":{"unit":"px","size":0,"sizes":[]},"button_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"button_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"button_background_attachment":"","button_background_repeat":"","button_background_repeat_tablet":"","button_background_repeat_mobile":"","button_background_size":"","button_background_size_tablet":"","button_background_size_mobile":"","button_background_bg_width":{"unit":"%","size":100,"sizes":[]},"button_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"button_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"button_background_video_link":"","button_background_video_start":"","button_background_video_end":"","button_background_play_once":"","button_background_play_on_mobile":"","button_background_privacy_mode":"","button_background_video_fallback":{"url":"","id":"","size":""},"button_background_slideshow_gallery":[],"button_background_slideshow_loop":"yes","button_background_slideshow_slide_duration":5000,"button_background_slideshow_slide_transition":"fade","button_background_slideshow_transition_duration":500,"button_background_slideshow_background_size":"","button_background_slideshow_background_size_tablet":"","button_background_slideshow_background_size_mobile":"","button_background_slideshow_background_position":"","button_background_slideshow_background_position_tablet":"","button_background_slideshow_background_position_mobile":"","button_background_slideshow_lazyload":"","button_background_slideshow_ken_burns":"","button_background_slideshow_ken_burns_zoom_direction":"in","button_border_width":{"unit":"px","top":3,"right":3,"bottom":3,"left":3,"isLinked":true},"button_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_border_color":"#666","advanced_button_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_shadow_box_shadow_type":"","advanced_button_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"advanced_button_shadow_box_shadow_position":" ","advanced_button_typography_typography":"","advanced_button_typography_font_family":"","advanced_button_typography_font_size":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_font_size_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_font_size_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_font_weight":"","advanced_button_typography_text_transform":"","advanced_button_typography_font_style":"","advanced_button_typography_text_decoration":"","advanced_button_typography_line_height":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_line_height_tablet":{"unit":"em","size":"","sizes":[]},"advanced_button_typography_line_height_mobile":{"unit":"em","size":"","sizes":[]},"advanced_button_typography_letter_spacing":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_letter_spacing_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_letter_spacing_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_word_spacing":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_word_spacing_tablet":{"unit":"em","size":"","sizes":[]},"advanced_button_typography_word_spacing_mobile":{"unit":"em","size":"","sizes":[]},"button_width":{"unit":"px","size":"","sizes":[]},"button_width_tablet":{"unit":"px","size":"","sizes":[]},"button_width_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_hover_text_color":"","button_hover_background_gradient_notice":"","button_hover_background_color":"","button_hover_background_color_stop":{"unit":"%","size":0,"sizes":[]},"button_hover_background_color_stop_tablet":{"unit":"%"},"button_hover_background_color_stop_mobile":{"unit":"%"},"button_hover_background_color_b":"#f2295b","button_hover_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"button_hover_background_color_b_stop_tablet":{"unit":"%"},"button_hover_background_color_b_stop_mobile":{"unit":"%"},"button_hover_background_gradient_type":"linear","button_hover_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"button_hover_background_gradient_angle_tablet":{"unit":"deg"},"button_hover_background_gradient_angle_mobile":{"unit":"deg"},"button_hover_background_gradient_position":"center center","button_hover_background_image":{"url":"","id":"","size":""},"button_hover_background_image_tablet":{"url":"","id":"","size":""},"button_hover_background_image_mobile":{"url":"","id":"","size":""},"button_hover_background_position":"","button_hover_background_position_tablet":"","button_hover_background_position_mobile":"","button_hover_background_xpos":{"unit":"px","size":0,"sizes":[]},"button_hover_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"button_hover_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"button_hover_background_ypos":{"unit":"px","size":0,"sizes":[]},"button_hover_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"button_hover_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"button_hover_background_attachment":"","button_hover_background_repeat":"","button_hover_background_repeat_tablet":"","button_hover_background_repeat_mobile":"","button_hover_background_size":"","button_hover_background_size_tablet":"","button_hover_background_size_mobile":"","button_hover_background_bg_width":{"unit":"%","size":100,"sizes":[]},"button_hover_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"button_hover_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"button_hover_background_video_link":"","button_hover_background_video_start":"","button_hover_background_video_end":"","button_hover_background_play_once":"","button_hover_background_play_on_mobile":"","button_hover_background_privacy_mode":"","button_hover_background_video_fallback":{"url":"","id":"","size":""},"button_hover_background_slideshow_gallery":[],"button_hover_background_slideshow_loop":"yes","button_hover_background_slideshow_slide_duration":5000,"button_hover_background_slideshow_slide_transition":"fade","button_hover_background_slideshow_transition_duration":500,"button_hover_background_slideshow_background_size":"","button_hover_background_slideshow_background_size_tablet":"","button_hover_background_slideshow_background_size_mobile":"","button_hover_background_slideshow_background_position":"","button_hover_background_slideshow_background_position_tablet":"","button_hover_background_slideshow_background_position_mobile":"","button_hover_background_slideshow_lazyload":"","button_hover_background_slideshow_ken_burns":"","button_hover_background_slideshow_ken_burns_zoom_direction":"in","button_hover_border_width":{"unit":"px","top":3,"right":3,"bottom":3,"left":3,"isLinked":true},"button_hover_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_hover_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_hover_border_color":"","advanced_button_hover_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_hover_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_hover_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_hover_shadow_box_shadow_type":"","advanced_button_hover_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"advanced_button_hover_shadow_box_shadow_position":" ","hover_animation":"","advanced_button_icon_color":"","advanced_button_icon_background_background":"","advanced_button_icon_background_gradient_notice":"","advanced_button_icon_background_color":"","advanced_button_icon_background_color_stop":{"unit":"%","size":0,"sizes":[]},"advanced_button_icon_background_color_stop_tablet":{"unit":"%"},"advanced_button_icon_background_color_stop_mobile":{"unit":"%"},"advanced_button_icon_background_color_b":"#f2295b","advanced_button_icon_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_background_color_b_stop_tablet":{"unit":"%"},"advanced_button_icon_background_color_b_stop_mobile":{"unit":"%"},"advanced_button_icon_background_gradient_type":"linear","advanced_button_icon_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"advanced_button_icon_background_gradient_angle_tablet":{"unit":"deg"},"advanced_button_icon_background_gradient_angle_mobile":{"unit":"deg"},"advanced_button_icon_background_gradient_position":"center center","advanced_button_icon_background_image":{"url":"","id":"","size":""},"advanced_button_icon_background_image_tablet":{"url":"","id":"","size":""},"advanced_button_icon_background_image_mobile":{"url":"","id":"","size":""},"advanced_button_icon_background_position":"","advanced_button_icon_background_position_tablet":"","advanced_button_icon_background_position_mobile":"","advanced_button_icon_background_xpos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_ypos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_attachment":"","advanced_button_icon_background_repeat":"","advanced_button_icon_background_repeat_tablet":"","advanced_button_icon_background_repeat_mobile":"","advanced_button_icon_background_size":"","advanced_button_icon_background_size_tablet":"","advanced_button_icon_background_size_mobile":"","advanced_button_icon_background_bg_width":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_background_video_link":"","advanced_button_icon_background_video_start":"","advanced_button_icon_background_video_end":"","advanced_button_icon_background_play_once":"","advanced_button_icon_background_play_on_mobile":"","advanced_button_icon_background_privacy_mode":"","advanced_button_icon_background_video_fallback":{"url":"","id":"","size":""},"advanced_button_icon_background_slideshow_gallery":[],"advanced_button_icon_background_slideshow_loop":"yes","advanced_button_icon_background_slideshow_slide_duration":5000,"advanced_button_icon_background_slideshow_slide_transition":"fade","advanced_button_icon_background_slideshow_transition_duration":500,"advanced_button_icon_background_slideshow_background_size":"","advanced_button_icon_background_slideshow_background_size_tablet":"","advanced_button_icon_background_slideshow_background_size_mobile":"","advanced_button_icon_background_slideshow_background_position":"","advanced_button_icon_background_slideshow_background_position_tablet":"","advanced_button_icon_background_slideshow_background_position_mobile":"","advanced_button_icon_background_slideshow_lazyload":"","advanced_button_icon_background_slideshow_ken_burns":"","advanced_button_icon_background_slideshow_ken_burns_zoom_direction":"in","advanced_button_icon_border_border":"","advanced_button_icon_border_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_border_color":"","advanced_button_icon_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_padding":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_padding_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_shadow_box_shadow_type":"","advanced_button_icon_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"advanced_button_icon_shadow_box_shadow_position":" ","advanced_button_icon_size":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_size_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_size_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_hover_icon_color":"","advanced_button_icon_hover_background_background":"","advanced_button_icon_hover_background_gradient_notice":"","advanced_button_icon_hover_background_color":"","advanced_button_icon_hover_background_color_stop":{"unit":"%","size":0,"sizes":[]},"advanced_button_icon_hover_background_color_stop_tablet":{"unit":"%"},"advanced_button_icon_hover_background_color_stop_mobile":{"unit":"%"},"advanced_button_icon_hover_background_color_b":"#f2295b","advanced_button_icon_hover_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_hover_background_color_b_stop_tablet":{"unit":"%"},"advanced_button_icon_hover_background_color_b_stop_mobile":{"unit":"%"},"advanced_button_icon_hover_background_gradient_type":"linear","advanced_button_icon_hover_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"advanced_button_icon_hover_background_gradient_angle_tablet":{"unit":"deg"},"advanced_button_icon_hover_background_gradient_angle_mobile":{"unit":"deg"},"advanced_button_icon_hover_background_gradient_position":"center center","advanced_button_icon_hover_background_image":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_image_tablet":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_image_mobile":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_position":"","advanced_button_icon_hover_background_position_tablet":"","advanced_button_icon_hover_background_position_mobile":"","advanced_button_icon_hover_background_xpos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_ypos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_attachment":"","advanced_button_icon_hover_background_repeat":"","advanced_button_icon_hover_background_repeat_tablet":"","advanced_button_icon_hover_background_repeat_mobile":"","advanced_button_icon_hover_background_size":"","advanced_button_icon_hover_background_size_tablet":"","advanced_button_icon_hover_background_size_mobile":"","advanced_button_icon_hover_background_bg_width":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_hover_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_hover_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_hover_background_video_link":"","advanced_button_icon_hover_background_video_start":"","advanced_button_icon_hover_background_video_end":"","advanced_button_icon_hover_background_play_once":"","advanced_button_icon_hover_background_play_on_mobile":"","advanced_button_icon_hover_background_privacy_mode":"","advanced_button_icon_hover_background_video_fallback":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_slideshow_gallery":[],"advanced_button_icon_hover_background_slideshow_loop":"yes","advanced_button_icon_hover_background_slideshow_slide_duration":5000,"advanced_button_icon_hover_background_slideshow_slide_transition":"fade","advanced_button_icon_hover_background_slideshow_transition_duration":500,"advanced_button_icon_hover_background_slideshow_background_size":"","advanced_button_icon_hover_background_slideshow_background_size_tablet":"","advanced_button_icon_hover_background_slideshow_background_size_mobile":"","advanced_button_icon_hover_background_slideshow_background_position":"","advanced_button_icon_hover_background_slideshow_background_position_tablet":"","advanced_button_icon_hover_background_slideshow_background_position_mobile":"","advanced_button_icon_hover_background_slideshow_lazyload":"","advanced_button_icon_hover_background_slideshow_ken_burns":"","advanced_button_icon_hover_background_slideshow_ken_burns_zoom_direction":"in","icon_hover_border_color":"","badge_color":"","badge_background_background":"","badge_background_gradient_notice":"","badge_background_color":"","badge_background_color_stop":{"unit":"%","size":0,"sizes":[]},"badge_background_color_stop_tablet":{"unit":"%"},"badge_background_color_stop_mobile":{"unit":"%"},"badge_background_color_b":"#f2295b","badge_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"badge_background_color_b_stop_tablet":{"unit":"%"},"badge_background_color_b_stop_mobile":{"unit":"%"},"badge_background_gradient_type":"linear","badge_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"badge_background_gradient_angle_tablet":{"unit":"deg"},"badge_background_gradient_angle_mobile":{"unit":"deg"},"badge_background_gradient_position":"center center","badge_background_image":{"url":"","id":"","size":""},"badge_background_image_tablet":{"url":"","id":"","size":""},"badge_background_image_mobile":{"url":"","id":"","size":""},"badge_background_position":"","badge_background_position_tablet":"","badge_background_position_mobile":"","badge_background_xpos":{"unit":"px","size":0,"sizes":[]},"badge_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_background_ypos":{"unit":"px","size":0,"sizes":[]},"badge_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_background_attachment":"","badge_background_repeat":"","badge_background_repeat_tablet":"","badge_background_repeat_mobile":"","badge_background_size":"","badge_background_size_tablet":"","badge_background_size_mobile":"","badge_background_bg_width":{"unit":"%","size":100,"sizes":[]},"badge_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"badge_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"badge_background_video_link":"","badge_background_video_start":"","badge_background_video_end":"","badge_background_play_once":"","badge_background_play_on_mobile":"","badge_background_privacy_mode":"","badge_background_video_fallback":{"url":"","id":"","size":""},"badge_background_slideshow_gallery":[],"badge_background_slideshow_loop":"yes","badge_background_slideshow_slide_duration":5000,"badge_background_slideshow_slide_transition":"fade","badge_background_slideshow_transition_duration":500,"badge_background_slideshow_background_size":"","badge_background_slideshow_background_size_tablet":"","badge_background_slideshow_background_size_mobile":"","badge_background_slideshow_background_position":"","badge_background_slideshow_background_position_tablet":"","badge_background_slideshow_background_position_mobile":"","badge_background_slideshow_lazyload":"","badge_background_slideshow_ken_burns":"","badge_background_slideshow_ken_burns_zoom_direction":"in","badge_border_border":"","badge_border_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_border_color":"","badge_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_padding":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_padding_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_shadow_box_shadow_type":"","badge_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"badge_shadow_box_shadow_position":" ","badge_typography_typography":"","badge_typography_font_family":"","badge_typography_font_size":{"unit":"px","size":"","sizes":[]},"badge_typography_font_size_tablet":{"unit":"px","size":"","sizes":[]},"badge_typography_font_size_mobile":{"unit":"px","size":"","sizes":[]},"badge_typography_font_weight":"","badge_typography_text_transform":"","badge_typography_font_style":"","badge_typography_text_decoration":"","badge_typography_line_height":{"unit":"px","size":"","sizes":[]},"badge_typography_line_height_tablet":{"unit":"em","size":"","sizes":[]},"badge_typography_line_height_mobile":{"unit":"em","size":"","sizes":[]},"badge_typography_letter_spacing":{"unit":"px","size":"","sizes":[]},"badge_typography_letter_spacing_tablet":{"unit":"px","size":"","sizes":[]},"badge_typography_letter_spacing_mobile":{"unit":"px","size":"","sizes":[]},"badge_typography_word_spacing":{"unit":"px","size":"","sizes":[]},"badge_typography_word_spacing_tablet":{"unit":"em","size":"","sizes":[]},"badge_typography_word_spacing_mobile":{"unit":"em","size":"","sizes":[]},"badge_hover_icon_color":"","badge_hover_background_background":"","badge_hover_background_gradient_notice":"","badge_hover_background_color":"","badge_hover_background_color_stop":{"unit":"%","size":0,"sizes":[]},"badge_hover_background_color_stop_tablet":{"unit":"%"},"badge_hover_background_color_stop_mobile":{"unit":"%"},"badge_hover_background_color_b":"#f2295b","badge_hover_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"badge_hover_background_color_b_stop_tablet":{"unit":"%"},"badge_hover_background_color_b_stop_mobile":{"unit":"%"},"badge_hover_background_gradient_type":"linear","badge_hover_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"badge_hover_background_gradient_angle_tablet":{"unit":"deg"},"badge_hover_background_gradient_angle_mobile":{"unit":"deg"},"badge_hover_background_gradient_position":"center center","badge_hover_background_image":{"url":"","id":"","size":""},"badge_hover_background_image_tablet":{"url":"","id":"","size":""},"badge_hover_background_image_mobile":{"url":"","id":"","size":""},"badge_hover_background_position":"","badge_hover_background_position_tablet":"","badge_hover_background_position_mobile":"","badge_hover_background_xpos":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_ypos":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_attachment":"","badge_hover_background_repeat":"","badge_hover_background_repeat_tablet":"","badge_hover_background_repeat_mobile":"","badge_hover_background_size":"","badge_hover_background_size_tablet":"","badge_hover_background_size_mobile":"","badge_hover_background_bg_width":{"unit":"%","size":100,"sizes":[]},"badge_hover_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"badge_hover_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"badge_hover_background_video_link":"","badge_hover_background_video_start":"","badge_hover_background_video_end":"","badge_hover_background_play_once":"","badge_hover_background_play_on_mobile":"","badge_hover_background_privacy_mode":"","badge_hover_background_video_fallback":{"url":"","id":"","size":""},"badge_hover_background_slideshow_gallery":[],"badge_hover_background_slideshow_loop":"yes","badge_hover_background_slideshow_slide_duration":5000,"badge_hover_background_slideshow_slide_transition":"fade","badge_hover_background_slideshow_transition_duration":500,"badge_hover_background_slideshow_background_size":"","badge_hover_background_slideshow_background_size_tablet":"","badge_hover_background_slideshow_background_size_mobile":"","badge_hover_background_slideshow_background_position":"","badge_hover_background_slideshow_background_position_tablet":"","badge_hover_background_slideshow_background_position_mobile":"","badge_hover_background_slideshow_lazyload":"","badge_hover_background_slideshow_ken_burns":"","badge_hover_background_slideshow_ken_burns_zoom_direction":"in","badge_hover_border_color":"","_title":"","_margin":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_margin_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_margin_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_padding":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_padding_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_element_width":"","_element_width_tablet":"","_element_width_mobile":"","_element_custom_width":{"unit":"%","size":"","sizes":[]},"_element_custom_width_tablet":{"unit":"px","size":"","sizes":[]},"_element_custom_width_mobile":{"unit":"px","size":"","sizes":[]},"_element_vertical_align":"","_element_vertical_align_tablet":"","_element_vertical_align_mobile":"","_position_description":"","_position":"","_offset_orientation_h":"start","_offset_x":{"unit":"px","size":0,"sizes":[]},"_offset_x_tablet":{"unit":"px","size":"","sizes":[]},"_offset_x_mobile":{"unit":"px","size":"","sizes":[]},"_offset_x_end":{"unit":"px","size":0,"sizes":[]},"_offset_x_end_tablet":{"unit":"px","size":"","sizes":[]},"_offset_x_end_mobile":{"unit":"px","size":"","sizes":[]},"_offset_orientation_v":"start","_offset_y":{"unit":"px","size":0,"sizes":[]},"_offset_y_tablet":{"unit":"px","size":"","sizes":[]},"_offset_y_mobile":{"unit":"px","size":"","sizes":[]},"_offset_y_end":{"unit":"px","size":0,"sizes":[]},"_offset_y_end_tablet":{"unit":"px","size":"","sizes":[]},"_offset_y_end_mobile":{"unit":"px","size":"","sizes":[]},"_z_index":"","_z_index_tablet":"","_z_index_mobile":"","_element_id":"","_css_classes":"","wcm_element_visibility_condition":"visible_to_everyone","wcm_element_visibility_show_plans":["wcm-all"],"wcm_element_visibility_hide_plans":["wcm-none"],"wcm_element_visibility_show_content_restricted_message":"","ep_widget_cf_confetti":"","ep_widget_cf_type":"basic","ep_widget_cf_fireworks_duration":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_anim_infinite":"","ep_widget_cf_particle_count":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_start_velocity":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_spread":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_angle":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_shape_type":"basic","ep_widget_cf_scalar":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_origin":"","ep_widget_cf_origin_x":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_origin_y":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_trigger_type":"load","ep_widget_cf_trigger_selector":"","ep_widget_cf_trigger_delay":{"unit":"px","size":3000,"sizes":[]},"ep_widget_cf_z_index":"","ep_display_conditions_enable":"","ep_display_conditions_to":"show","ep_display_conditions_relation":"all","ep_floating_effects_show":"","ep_floating_effects_translate_toggle":"","ep_floating_effects_translate_x":{"unit":"px","size":"","sizes":{"from":0,"to":0}},"ep_floating_effects_translate_y":{"unit":"px","size":"","sizes":{"from":0,"to":30}},"ep_floating_effects_translate_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_translate_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_rotate_toggle":"","ep_floating_effects_rotate_x":{"unit":"deg","size":"","sizes":{"from":0,"to":0}},"ep_floating_effects_rotate_y":{"unit":"deg","size":"","sizes":{"from":0,"to":0}},"ep_floating_effects_rotate_z":{"unit":"deg","size":"","sizes":{"from":0,"to":45}},"ep_floating_effects_rotate_infinite":"","ep_floating_effects_rotate_duration":{"unit":"px","size":2000,"sizes":[]},"ep_floating_effects_rotate_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_scale_toggle":"","ep_floating_effects_scale_x":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_scale_y":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_scale_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_scale_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_skew_toggle":"","ep_floating_effects_skew_x":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_skew_y":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_skew_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_skew_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_border_radius_toggle":"","ep_floating_effects_border_radius":{"unit":"px","size":"","sizes":{"from":0,"to":50}},"ep_floating_effects_border_radius_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_border_radius_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_opacity_toggle":"","ep_floating_effects_opacity_start":{"unit":"px","size":1,"sizes":[]},"ep_floating_effects_opacity_end":{"unit":"px","size":0,"sizes":[]},"ep_floating_effects_opacity_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_easing":"easeInOutQuad","ep_parallax_effects_show":"","ep_parallax_effects_x":"","ep_parallax_effects_x_start":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_x_end":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_x_custom_show":"","ep_parallax_effects_x_custom_value":"","ep_parallax_effects_y":"","ep_parallax_effects_y_start":{"unit":"px","size":50,"sizes":[]},"ep_parallax_effects_y_end":{"unit":"px","size":0,"sizes":[]},"ep_parallax_effects_y_custom_show":"","ep_parallax_effects_y_custom_value":"","ep_parallax_effects_opacity_toggole":"","ep_parallax_effects_opacity":"","ep_parallax_effects_opacity_custom_show":"","ep_parallax_effects_opacity_custom_value":"","ep_parallax_effects_blur":"","ep_parallax_effects_blur_start":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_blur_end":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_rotate":"","ep_parallax_effects_rotate_start":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_rotate_end":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_scale":"","ep_parallax_effects_scale_start":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_scale_end":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_hue":"","ep_parallax_effects_hue_value":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_sepia":"","ep_parallax_effects_sepia_value":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_easing":"","ep_parallax_effects_easing_value":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_transition":"","ep_parallax_effects_viewport":"","ep_parallax_effects_viewport_start":"","ep_parallax_effects_viewport_end":"","ep_parallax_effects_media_query":"","ep_parallax_effects_target":"self","motion_fx_motion_fx_scrolling":"","motion_fx_translateY_effect":"","motion_fx_translateY_direction":"","motion_fx_translateY_speed":{"unit":"px","size":4,"sizes":[]},"motion_fx_translateY_affectedRange":{"unit":"%","size":"","sizes":{"start":0,"end":100}},"motion_fx_translateX_effect":"","motion_fx_translateX_direction":"","motion_fx_translateX_speed":{"unit":"px","size":4,"sizes":[]},"motion_fx_translateX_affectedRange":{"unit":"%","size":"","sizes":{"start":0,"end":100}},"motion_fx_opacity_effect":"","motion_fx_opacity_direction":"out-in","motion_fx_opacity_level":{"unit":"px","size":10,"sizes":[]},"motion_fx_opacity_range":{"unit":"%","size":"","sizes":{"start":20,"end":80}},"motion_fx_blur_effect":"","motion_fx_blur_direction":"out-in","motion_fx_blur_level":{"unit":"px","size":7,"sizes":[]},"motion_fx_blur_range":{"unit":"%","size":"","sizes":{"start":20,"end":80}},"motion_fx_rotateZ_effect":"","motion_fx_rotateZ_direction":"","motion_fx_rotateZ_speed":{"unit":"px","size":1,"sizes":[]},"motion_fx_rotateZ_affectedRange":{"unit":"%","size":"","sizes":{"start":0,"end":100}},"motion_fx_scale_effect":"","motion_fx_scale_direction":"out-in","motion_fx_scale_speed":{"unit":"px","size":4,"sizes":[]},"motion_fx_scale_range":{"unit":"%","size":"","sizes":{"start":20,"end":80}},"motion_fx_transform_origin_x":"center","motion_fx_transform_origin_y":"center","motion_fx_devices":["desktop","tablet","mobile"],"motion_fx_range":"","motion_fx_motion_fx_mouse":"","motion_fx_mouseTrack_effect":"","motion_fx_mouseTrack_direction":"","motion_fx_mouseTrack_speed":{"unit":"px","size":1,"sizes":[]},"motion_fx_tilt_effect":"","motion_fx_tilt_direction":"","motion_fx_tilt_speed":{"unit":"px","size":4,"sizes":[]},"sticky":"","sticky_on":["desktop","tablet","mobile"],"sticky_offset":0,"sticky_offset_tablet":"","sticky_offset_mobile":"","sticky_effects_offset":0,"sticky_effects_offset_tablet":"","sticky_effects_offset_mobile":"","sticky_parent":"","_animation":"","_animation_tablet":"","_animation_mobile":"","animation_duration":"","_animation_delay":"","_transform_rotate_popover":"","_transform_rotateZ_effect":{"unit":"px","size":"","sizes":[]},"_transform_rotateZ_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateZ_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotate_3d":"","_transform_rotateX_effect":{"unit":"px","size":"","sizes":[]},"_transform_rotateX_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateX_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect":{"unit":"px","size":"","sizes":[]},"_transform_rotateY_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_perspective_effect":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translate_popover":"","_transform_translateX_effect":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scale_popover":"","_transform_keep_proportions":"yes","_transform_scale_effect":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_skew_popover":"","_transform_skewX_effect":{"unit":"px","size":"","sizes":[]},"_transform_skewX_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewX_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect":{"unit":"px","size":"","sizes":[]},"_transform_skewY_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_flipX_effect":"","_transform_flipY_effect":"","_transform_rotate_popover_hover":"","_transform_rotateZ_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_rotateZ_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateZ_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotate_3d_hover":"","_transform_rotateX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_rotateX_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateX_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_rotateY_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_perspective_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translate_popover_hover":"","_transform_translateX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scale_popover_hover":"","_transform_keep_proportions_hover":"yes","_transform_scale_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_skew_popover_hover":"","_transform_skewX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_skewX_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewX_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_skewY_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_flipX_effect_hover":"","_transform_flipY_effect_hover":"","_transform_transition_hover":{"unit":"px","size":"","sizes":[]},"motion_fx_transform_x_anchor_point":"","motion_fx_transform_x_anchor_point_tablet":"","motion_fx_transform_x_anchor_point_mobile":"","motion_fx_transform_y_anchor_point":"","motion_fx_transform_y_anchor_point_tablet":"","motion_fx_transform_y_anchor_point_mobile":"","_background_background":"","_background_gradient_notice":"","_background_color":"","_background_color_stop":{"unit":"%","size":0,"sizes":[]},"_background_color_stop_tablet":{"unit":"%"},"_background_color_stop_mobile":{"unit":"%"},"_background_color_b":"#f2295b","_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"_background_color_b_stop_tablet":{"unit":"%"},"_background_color_b_stop_mobile":{"unit":"%"},"_background_gradient_type":"linear","_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"_background_gradient_angle_tablet":{"unit":"deg"},"_background_gradient_angle_mobile":{"unit":"deg"},"_background_gradient_position":"center center","_background_image":{"url":"","id":"","size":""},"_background_image_tablet":{"url":"","id":"","size":""},"_background_image_mobile":{"url":"","id":"","size":""},"_background_position":"","_background_position_tablet":"","_background_position_mobile":"","_background_xpos":{"unit":"px","size":0,"sizes":[]},"_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_ypos":{"unit":"px","size":0,"sizes":[]},"_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_attachment":"","_background_repeat":"","_background_repeat_tablet":"","_background_repeat_mobile":"","_background_size":"","_background_size_tablet":"","_background_size_mobile":"","_background_bg_width":{"unit":"%","size":100,"sizes":[]},"_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"_background_video_link":"","_background_video_start":"","_background_video_end":"","_background_play_once":"","_background_play_on_mobile":"","_background_privacy_mode":"","_background_video_fallback":{"url":"","id":"","size":""},"_background_slideshow_gallery":[],"_background_slideshow_loop":"yes","_background_slideshow_slide_duration":5000,"_background_slideshow_slide_transition":"fade","_background_slideshow_transition_duration":500,"_background_slideshow_background_size":"","_background_slideshow_background_size_tablet":"","_background_slideshow_background_size_mobile":"","_background_slideshow_background_position":"","_background_slideshow_background_position_tablet":"","_background_slideshow_background_position_mobile":"","_background_slideshow_lazyload":"","_background_slideshow_ken_burns":"","_background_slideshow_ken_burns_zoom_direction":"in","_background_hover_background":"","_background_hover_gradient_notice":"","_background_hover_color":"","_background_hover_color_stop":{"unit":"%","size":0,"sizes":[]},"_background_hover_color_stop_tablet":{"unit":"%"},"_background_hover_color_stop_mobile":{"unit":"%"},"_background_hover_color_b":"#f2295b","_background_hover_color_b_stop":{"unit":"%","size":100,"sizes":[]},"_background_hover_color_b_stop_tablet":{"unit":"%"},"_background_hover_color_b_stop_mobile":{"unit":"%"},"_background_hover_gradient_type":"linear","_background_hover_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"_background_hover_gradient_angle_tablet":{"unit":"deg"},"_background_hover_gradient_angle_mobile":{"unit":"deg"},"_background_hover_gradient_position":"center center","_background_hover_image":{"url":"","id":"","size":""},"_background_hover_image_tablet":{"url":"","id":"","size":""},"_background_hover_image_mobile":{"url":"","id":"","size":""},"_background_hover_position":"","_background_hover_position_tablet":"","_background_hover_position_mobile":"","_background_hover_xpos":{"unit":"px","size":0,"sizes":[]},"_background_hover_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_hover_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_hover_ypos":{"unit":"px","size":0,"sizes":[]},"_background_hover_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_hover_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_hover_attachment":"","_background_hover_repeat":"","_background_hover_repeat_tablet":"","_background_hover_repeat_mobile":"","_background_hover_size":"","_background_hover_size_tablet":"","_background_hover_size_mobile":"","_background_hover_bg_width":{"unit":"%","size":100,"sizes":[]},"_background_hover_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"_background_hover_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"_background_hover_video_link":"","_background_hover_video_start":"","_background_hover_video_end":"","_background_hover_play_once":"","_background_hover_play_on_mobile":"","_background_hover_privacy_mode":"","_background_hover_video_fallback":{"url":"","id":"","size":""},"_background_hover_slideshow_gallery":[],"_background_hover_slideshow_loop":"yes","_background_hover_slideshow_slide_duration":5000,"_background_hover_slideshow_slide_transition":"fade","_background_hover_slideshow_transition_duration":500,"_background_hover_slideshow_background_size":"","_background_hover_slideshow_background_size_tablet":"","_background_hover_slideshow_background_size_mobile":"","_background_hover_slideshow_background_position":"","_background_hover_slideshow_background_position_tablet":"","_background_hover_slideshow_background_position_mobile":"","_background_hover_slideshow_lazyload":"","_background_hover_slideshow_ken_burns":"","_background_hover_slideshow_ken_burns_zoom_direction":"in","_background_hover_transition":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_background":"","ep_background_overlay_gradient_notice":"","ep_background_overlay_color":"","ep_background_overlay_color_stop":{"unit":"%","size":0,"sizes":[]},"ep_background_overlay_color_stop_tablet":{"unit":"%"},"ep_background_overlay_color_stop_mobile":{"unit":"%"},"ep_background_overlay_color_b":"#f2295b","ep_background_overlay_color_b_stop":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_color_b_stop_tablet":{"unit":"%"},"ep_background_overlay_color_b_stop_mobile":{"unit":"%"},"ep_background_overlay_gradient_type":"linear","ep_background_overlay_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"ep_background_overlay_gradient_angle_tablet":{"unit":"deg"},"ep_background_overlay_gradient_angle_mobile":{"unit":"deg"},"ep_background_overlay_gradient_position":"center center","ep_background_overlay_image":{"url":"","id":"","size":""},"ep_background_overlay_image_tablet":{"url":"","id":"","size":""},"ep_background_overlay_image_mobile":{"url":"","id":"","size":""},"ep_background_overlay_position":"","ep_background_overlay_position_tablet":"","ep_background_overlay_position_mobile":"","ep_background_overlay_xpos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_ypos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_attachment":"","ep_background_overlay_repeat":"","ep_background_overlay_repeat_tablet":"","ep_background_overlay_repeat_mobile":"","ep_background_overlay_size":"","ep_background_overlay_size_tablet":"","ep_background_overlay_size_mobile":"","ep_background_overlay_bg_width":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_video_link":"","ep_background_overlay_video_start":"","ep_background_overlay_video_end":"","ep_background_overlay_play_once":"","ep_background_overlay_play_on_mobile":"","ep_background_overlay_privacy_mode":"","ep_background_overlay_video_fallback":{"url":"","id":"","size":""},"ep_background_overlay_slideshow_gallery":[],"ep_background_overlay_slideshow_loop":"yes","ep_background_overlay_slideshow_slide_duration":5000,"ep_background_overlay_slideshow_slide_transition":"fade","ep_background_overlay_slideshow_transition_duration":500,"ep_background_overlay_slideshow_background_size":"","ep_background_overlay_slideshow_background_size_tablet":"","ep_background_overlay_slideshow_background_size_mobile":"","ep_background_overlay_slideshow_background_position":"","ep_background_overlay_slideshow_background_position_tablet":"","ep_background_overlay_slideshow_background_position_mobile":"","ep_background_overlay_slideshow_lazyload":"","ep_background_overlay_slideshow_ken_burns":"","ep_background_overlay_slideshow_ken_burns_zoom_direction":"in","ep_background_overlay_opacity":{"unit":"px","size":0.5,"sizes":[]},"ep_css_filters_css_filter":"","ep_css_filters_blur":{"unit":"px","size":0,"sizes":[]},"ep_css_filters_brightness":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_contrast":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_saturate":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hue":{"unit":"px","size":0,"sizes":[]},"ep_overlay_blend_mode":"","ep_background_overlay_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_hover_background":"","ep_background_overlay_hover_gradient_notice":"","ep_background_overlay_hover_color":"","ep_background_overlay_hover_color_stop":{"unit":"%","size":0,"sizes":[]},"ep_background_overlay_hover_color_stop_tablet":{"unit":"%"},"ep_background_overlay_hover_color_stop_mobile":{"unit":"%"},"ep_background_overlay_hover_color_b":"#f2295b","ep_background_overlay_hover_color_b_stop":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_hover_color_b_stop_tablet":{"unit":"%"},"ep_background_overlay_hover_color_b_stop_mobile":{"unit":"%"},"ep_background_overlay_hover_gradient_type":"linear","ep_background_overlay_hover_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"ep_background_overlay_hover_gradient_angle_tablet":{"unit":"deg"},"ep_background_overlay_hover_gradient_angle_mobile":{"unit":"deg"},"ep_background_overlay_hover_gradient_position":"center center","ep_background_overlay_hover_image":{"url":"","id":"","size":""},"ep_background_overlay_hover_image_tablet":{"url":"","id":"","size":""},"ep_background_overlay_hover_image_mobile":{"url":"","id":"","size":""},"ep_background_overlay_hover_position":"","ep_background_overlay_hover_position_tablet":"","ep_background_overlay_hover_position_mobile":"","ep_background_overlay_hover_xpos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_ypos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_attachment":"","ep_background_overlay_hover_repeat":"","ep_background_overlay_hover_repeat_tablet":"","ep_background_overlay_hover_repeat_mobile":"","ep_background_overlay_hover_size":"","ep_background_overlay_hover_size_tablet":"","ep_background_overlay_hover_size_mobile":"","ep_background_overlay_hover_bg_width":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_hover_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_hover_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_hover_video_link":"","ep_background_overlay_hover_video_start":"","ep_background_overlay_hover_video_end":"","ep_background_overlay_hover_play_once":"","ep_background_overlay_hover_play_on_mobile":"","ep_background_overlay_hover_privacy_mode":"","ep_background_overlay_hover_video_fallback":{"url":"","id":"","size":""},"ep_background_overlay_hover_slideshow_gallery":[],"ep_background_overlay_hover_slideshow_loop":"yes","ep_background_overlay_hover_slideshow_slide_duration":5000,"ep_background_overlay_hover_slideshow_slide_transition":"fade","ep_background_overlay_hover_slideshow_transition_duration":500,"ep_background_overlay_hover_slideshow_background_size":"","ep_background_overlay_hover_slideshow_background_size_tablet":"","ep_background_overlay_hover_slideshow_background_size_mobile":"","ep_background_overlay_hover_slideshow_background_position":"","ep_background_overlay_hover_slideshow_background_position_tablet":"","ep_background_overlay_hover_slideshow_background_position_mobile":"","ep_background_overlay_hover_slideshow_lazyload":"","ep_background_overlay_hover_slideshow_ken_burns":"","ep_background_overlay_hover_slideshow_ken_burns_zoom_direction":"in","ep_background_overlay_hover_opacity":{"unit":"px","size":0.5,"sizes":[]},"ep_css_filters_hover_css_filter":"","ep_css_filters_hover_blur":{"unit":"px","size":0,"sizes":[]},"ep_css_filters_hover_brightness":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hover_contrast":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hover_saturate":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hover_hue":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_transition_duration":{"unit":"px","size":0.3,"sizes":[]},"ep_background_overlay_hover_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_hover_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_hover_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_margin":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_margin_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_margin_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_zindex":"","ep_background_overlay_position_relative":"","ep_background_overlay_widget_zindex":"-1","_border_border":"","_border_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_color":"","_border_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_box_shadow_box_shadow_type":"","_box_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"_box_shadow_box_shadow_position":" ","_border_hover_border":"","_border_hover_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_hover_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_hover_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_hover_color":"","_border_radius_hover":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_hover_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_hover_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_box_shadow_hover_box_shadow_type":"","_box_shadow_hover_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"_box_shadow_hover_box_shadow_position":" ","_border_hover_transition":{"unit":"px","size":"","sizes":[]},"_mask_switch":"","_mask_shape":"circle","_mask_image":{"url":"","id":"","size":""},"_mask_notice":"","_mask_size":"contain","_mask_size_tablet":"","_mask_size_mobile":"","_mask_size_scale":{"unit":"%","size":100,"sizes":[]},"_mask_size_scale_tablet":{"unit":"px","size":"","sizes":[]},"_mask_size_scale_mobile":{"unit":"px","size":"","sizes":[]},"_mask_position":"center center","_mask_position_tablet":"","_mask_position_mobile":"","_mask_position_x":{"unit":"%","size":0,"sizes":[]},"_mask_position_x_tablet":{"unit":"px","size":"","sizes":[]},"_mask_position_x_mobile":{"unit":"px","size":"","sizes":[]},"_mask_position_y":{"unit":"%","size":0,"sizes":[]},"_mask_position_y_tablet":{"unit":"px","size":"","sizes":[]},"_mask_position_y_mobile":{"unit":"px","size":"","sizes":[]},"_mask_repeat":"no-repeat","_mask_repeat_tablet":"","_mask_repeat_mobile":"","hide_desktop":"","hide_tablet":"","hide_mobile":"","_attributes":"","custom_css":""},"defaultEditSettings":{"defaultEditRoute":"content"},"elements":[],"widgetType":"bdt-advanced-button","editSettings":{"defaultEditRoute":"content"},"htmlCache":""}]}](https://consultorsalud.com/wp-content/uploads/2024/03/1080x1080_portal_central-de-mezclas_01-1.jpg)
