- PUBLICADO:
Así se fijarán los precios de medicamentos ya existentes en el mercado nacional

Escucha esta noticia
Cargando audio...
En un artículo previo, presentamos los detalles más importantes de la actualización al régimen de control de precios de medicamentos. Para dar claridad sobre la metodología expuesta en la Circular 18 de 2024, en este nos referiremos al proceso que se llevará a cabo para el control de precios de medicamentos que no se consideren nuevos para el sistema de salud nacional.
En el Capítulo II del documento expedido, el Ministerio de Salud explica los criterios metodológicos que se toman en cuenta desde la Comisión de Medicamentos y el proceso a seguir, iniciando con la conformación del mercado relevante. Este proceso comienza con la identificación detallada de cada medicamento, utilizando la información del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA). Para cada medicamento, se determina su principio activo, forma farmacéutica y vía de administración, lo que ayuda a agrupar los medicamentos con características similares.
Después de recopilar la información inicial, se clasificarán los medicamentos según su forma farmacéutica agrupada (FFA) y se estandarizará la nomenclatura de su principio activo según la Denominación Común Internacional (DCI). Los medicamentos que compartan la misma DCI y FFA se agruparán para formar un mercado relevante único. Dentro de cada mercado relevante, se normalizará la cantidad de principio activo para que todos los medicamentos se expresen en una unidad de medida común, facilitando así la comparación y el análisis.
Además, cada mercado relevante será objeto de una evaluación detallada para asegurar que su constitución responde adecuadamente a las características y necesidades específicas. Esta revisión permitirá identificar cualquier excepción que deba considerarse en la conformación del mercado, garantizando que la agrupación de medicamentos en mercados relevantes sea precisa y refleje adecuadamente las dinámicas del mercado farmacéutico.
¿Cómo se hará la puntuación de los mercados relevantes elegidos?
Para evaluar cada mercado relevante, la CNPMDM asigna un puntaje basado en dos criterios principales: la participación de ventas y la concentración de mercado. En Colombia, el proceso se regirá por varios criterios, descritos a continuación:
Para evaluar la participación de ventas, se analizarán los datos de ventas de los últimos tres años de cada oferente en los mercados relevantes, recabados del Sistema de Información de Precios de Medicamentos (SISMED). Se sumarán las ventas de todos los oferentes en cada mercado para determinar el total de ventas. Los mercados se clasificarán según su volumen de ventas, asignándoles un puntaje basado en su posición en el percentil de ventas: los que estén por encima del 75% recibirán un puntaje de 5, los que estén entre el 50% y el 75% recibirán un puntaje de 3, y aquellos por debajo del 50% obtendrán un puntaje de 1.
Además, se evaluará la concentración del mercado usando el índice de Herfindahl-Hirschman para determinar el nivel de competencia dentro de cada mercado relevante. Un índice de 10.000 indica máxima concentración y recibe un puntaje de 3, un índice entre 2.500 y 10.000 recibe un puntaje de 2, y un índice menor a 2.500 obtiene un puntaje de 1, indicando un mercado menos concentrado.
El puntaje final de cada mercado relevante se calcula sumando los puntajes de participación de ventas y concentración del mercado. Este puntaje final determina la clasificación del mercado en uno de dos grupos para su régimen de control de precios: el Grupo A, con un puntaje entre 5 y 8, quedará bajo control directo de precios; y el Grupo B, con un puntaje entre 2 y 4, será excluido del control directo y pasará a un régimen de libertad vigilada.
“Si el mercado relevante obtiene un puntaje de 1 en el criterio denominado “Concentración del mercado relevante” descrito en el artículo 14 del presente acto administrativo, este mercado entrará directamente al régimen de libertad vigilada, independientemente del puntaje que el mercado relevante haya obtenido en el criterio denominado “Participación de ventas””, señala la Circular 18 de 2024.
La CNPMDM se compromete a hacer pública la lista de mercados relevantes anualmente, incluyendo el puntaje asignado a cada criterio, el puntaje total, la categorización de los grupos, y los datos del SISMED utilizados en el análisis. Esta información estará disponible para consulta pública y se actualizará cada año.
En cuanto a los medicamentos clasificados como vitales no disponibles, que por su importancia y necesidad crítica son considerados excepcionales, se les asignará automáticamente al Grupo A, independientemente de los criterios generales. Esto asegura su acceso continuo y controlado en el mercado.
Por otro lado, la Secretaría Técnica de la CNPMDM se encargará de definir cuáles de los mercados relevantes del Grupo A serán sujetos al control directo de precios. Además, decidirá cuáles mercados requieren una actualización de su precio base. Para estas decisiones, se seguirá la metodología detallada en esta circular, garantizando así un proceso de evaluación coherente y sistemático.
Proceso para la determinación del precio máximo de venta de medicamentos
Para determinar el precio de los medicamentos dentro de un mercado relevante, se analizarán los datos de transacciones primarias institucionales y comerciales reportados al SISMED por los oferentes. Se calculará el total de ventas y la cantidad de medicamentos vendidos, utilizando una unidad de medida estándar para ese mercado. El precio por oferente se obtendrá dividiendo el total de ventas por la cantidad total de medicamentos vendidos. Esta información, usada para el cálculo del precio por oferente, será divulgada por la Comisión.
Para el Precio de Referencia Nacional (PRN), se organizarán los precios de los oferentes de mayor a menor, y se determinará el percentil 90 para establecer el PRN del mercado. La CNPMDM también publicará los datos usados para calcular el PRN.
El cálculo del precio base para un mercado relevante considerará la cantidad de oferentes. Con un solo oferente, el precio base será el menor entre el percentil 20 de los precios de referencia internacional (PRI 20) y el precio del oferente. Con dos o más oferentes, se tomará el menor entre el PRI 20 y el PRN. Si la información de menos de cuatro países está disponible, el cálculo se ajustará usando el precio del oferente o el PRN directamente, dependiendo de la cantidad de oferentes en el mercado. La Secretaría Técnica de la CNPMDM supervisará la dinámica de los mercados relevantes y evaluará el impacto de establecer el PRN como precio base, ajustando las estrategias de precio según sea necesario.
“El Precio Máximo de Venta para todos los medicamentos que componen un mercado relevante será igual al precio base,, incrementado en el margen de ajuste y su ámbito de aplicación será según lo dispuesto en esta Circular”, enfatiza el documento.
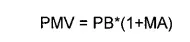
Fórmula para el precio máximo de venta de medicamentos.
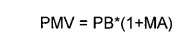
Si el actor que realiza la transacción final institucional es una Institución Prestadora de Servicios de Salud, el PMV incorporará el margen de ajuste para las IPS.
Cada año, la CNPMDM hará la actualización correspondiente al precio máximo de venta de medicamentos de cada mercado relevante definido y que hayan sido objeto de control directo de precios. Para este proceso, se tomarán en cuenta las siguientes condiciones:
- Se actualizarán las tasas de cambio y se calcularán sus variaciones porcentuales desde el día en el que fue incorporado el mercado relevante al régimen de control directo, o, desde el día de su última actualización de precio.
- Posteriormente, se calculará el promedio simple de las variaciones porcentuales de las tasas de cambio (PVTC).
- El precio máximo de venta se actualizará considerando el valor obtenido en el punto anterior bajo la fórmula: PMV actualizado = PMV*(1+PVTC).
“Cuando un titular obtenga el registro sanitario para un medicamento cuyos ingredientes farmacéuticos activos están incluidos en normas farmacológicas y se disponga a comercializarlo en el país, deberá notificarlo mediante radicado dirigido a la Secretaría Técnica de la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos, indicando el precio al cual pretenden vender el medicamento para la transacción primaria institucional y la transacción primaria comercial, el cual será usado solo con fines de monitoreo”, explica la Circular 18 de 2024.
¿Qué se consideran excepciones para la conformación de mercados relevantes?
En circunstancias especiales y fundamentadas, la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos tiene la facultad de considerar ciertos factores para definir los mercados relevantes. Medicamentos con diferentes Denominaciones Comunes Internacionales (DCI) o combinaciones de DCI y forma farmacéutica agrupada (FFA) pueden agruparse en un único mercado relevante si presentan indicaciones, así como propiedades farmacocinéticas y farmacodinámicas similares.
Además, se podrá segmentar un mercado relevante en submercados cuando medicamentos con la misma DCI-FFA varíen en términos de indicaciones, concentraciones, características farmacocinéticas, formas farmacéuticas o métodos de administración. Asimismo, los medicamentos que contienen dos o más principios activos combinados, y muestran proporciones no equivalentes en las concentraciones de estos principios, también podrán constituir submercados distintos.
Para que estas excepciones sean consideradas, los interesados deben presentar la justificación y los datos pertinentes a la Secretaría Técnica de la CNPMDM, que evaluará la información proporcionada y determinará la procedencia de aplicar dichas excepciones en la configuración de los mercados relevantes.
¿Cuáles son las excepciones al procedimiento descritas en la Circular 18 de 2024?
En situaciones excepcionales y con justificación adecuada, la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos tiene la autoridad para fijar o revisar el precio máximo de venta para ciertos mercados relevantes, sin atenerse estrictamente a la clasificación del artículo 15 de la circular. Esto puede ocurrir bajo circunstancias específicas como:
- Un impacto financiero significativo en el Sistema de Salud debido a los costos asociados con un mercado relevante.
- La necesidad de proteger la salud pública durante epidemias, pandemias, emergencias sanitarias o situaciones de urgencia nacional, donde los medicamentos del mercado relevante son cruciales.
- Incrementos no justificados en el precio de referencia nacional para los medicamentos en un mercado relevante.
Bajo estas condiciones, la Comisión puede ajustar el precio base y establecer el Precio Máximo de Venta en proporción a este, conforme a las directrices de la circular actual.
Finalmente, la Circular 18 de 2024 subraya que, las circulares que contienen precios máximos de venta emitidas con base en la metodología de la Circular 03 de 2013 mantendrán su vigencia hasta cuando sean actualizados los precios máximos de venta con las nuevas instrucciones.
Recuerda que puedes encontrar el documento en el artículo previo: “Instauran régimen de control de precios a medicamentos – Circular 18 de 2024”, haciendo clic aquí.





















![{"type":"elementor","siteurl":"https://consultorsalud.com/wp-json/","elements":[{"id":"37e6683","elType":"widget","isInner":false,"isLocked":false,"settings":{"text":"IR AL CURSO","link":{"url":"https://formarsalud.com/cursos/estrategias-para-el-saneamiento-financiero-de-ips-en-crisis/","is_external":"","nofollow":"","custom_attributes":""},"align":"center","badge_text":"Badge","button_effect":"c","advanced_button_text_color":"#FFFFFF","button_background_background":"classic","button_border_style":"none","button_hover_background_background":"classic","button_hover_border_style":"none","wcm_element_visibility_content_restricted_message":"You are not authorized to view this content.","ep_widget_cf_colors":"#D30C5C, #0EBCDC, #EAED41, #ED5A78, #DF33DF","ep_display_conditions":[],"ep_parallax_effects_transition_for":"all","ep_parallax_effects_transition_duration":"100","ep_parallax_effects_transition_easing":"linear","__globals__":{"advanced_button_text_color":"","button_background_color":"globals/colors?id=3ab82b4d","button_hover_background_color":"globals/colors?id=50006a26"},"advanced_button_padding":{"unit":"px","top":"7","right":"20","bottom":"7","left":"20","isLinked":false},"advanced_button_padding_tablet":{"unit":"px","top":"7","right":"20","bottom":"7","left":"20","isLinked":false},"ep_widget_cf_shapes":"square|circle","ep_widget_cf_shapes_emoji":"🎃|🎄|💜","ep_widget_cf_shapes_svg":"M167 72c19,-38 37,-56 75,-56 42,0 76,33 76,75 0,76 -76,151 -151,227 -76,-76 -151,-151 -151,-227 0,-42 33,-75 75,-75 38,0 57,18 76,56z|M120 240c-41,14 -91,18 -120,1 29,-10 57,-22 81,-40 -18,2 -37,3 -55,-3 25,-14 48,-30 66,-51 -11,5 -26,8 -45,7 20,-14 40,-30 57,-49 -13,1 -26,2 -38,-1 18,-11 35,-25 51,-43 -13,3 -24,5 -35,6 21,-19 40,-41 53,-67 14,26 32,48 54,67 -11,-1 -23,-3 -35,-6 15,18 32,32 51,43 -13,3 -26,2 -38,1 17,19 36,35 56,49 -19,1 -33,-2 -45,-7 19,21 42,37 67,51 -19,6 -37,5 -56,3 25,18 53,30 82,40 -30,17 -79,13 -120,-1l0 41 -31 0 0 -41z|M449.4 142c-5 0-10 .3-15 1a183 183 0 0 0-66.9-19.1V87.5a17.5 17.5 0 1 0-35 0v36.4a183 183 0 0 0-67 19c-4.9-.6-9.9-1-14.8-1C170.3 142 105 219.6 105 315s65.3 173 145.7 173c5 0 10-.3 14.8-1a184.7 184.7 0 0 0 169 0c4.9.7 9.9 1 14.9 1 80.3 0 145.6-77.6 145.6-173s-65.3-173-145.7-173zm-220 138 27.4-40.4a11.6 11.6 0 0 1 16.4-2.7l54.7 40.3a11.3 11.3 0 0 1-7 20.3H239a11.3 11.3 0 0 1-9.6-17.5zM444 383.8l-43.7 17.5a17.7 17.7 0 0 1-13 0l-37.3-15-37.2 15a17.8 17.8 0 0 1-13 0L256 383.8a17.5 17.5 0 0 1 13-32.6l37.3 15 37.2-15c4.2-1.6 8.8-1.6 13 0l37.3 15 37.2-15a17.5 17.5 0 0 1 13 32.6zm17-86.3h-82a11.3 11.3 0 0 1-6.9-20.4l54.7-40.3a11.6 11.6 0 0 1 16.4 2.8l27.4 40.4a11.3 11.3 0 0 1-9.6 17.5z","add_custom_attributes":"","custom_attributes":"","button_size":"md","onclick":"","onclick_event":"","align_tablet":"","align_mobile":"","button_icon":{"value":"","library":""},"icon_align_choose":"center","icon_align":"right","icon_indent":{"unit":"px","size":8,"sizes":[]},"show_button_badge":"","badge_align":"right","badge_indent":{"unit":"px","size":8,"sizes":[]},"button_css_id":"","attention_button":"","button_background_gradient_notice":"","button_background_color":"","button_background_color_stop":{"unit":"%","size":0,"sizes":[]},"button_background_color_stop_tablet":{"unit":"%"},"button_background_color_stop_mobile":{"unit":"%"},"button_background_color_b":"#f2295b","button_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"button_background_color_b_stop_tablet":{"unit":"%"},"button_background_color_b_stop_mobile":{"unit":"%"},"button_background_gradient_type":"linear","button_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"button_background_gradient_angle_tablet":{"unit":"deg"},"button_background_gradient_angle_mobile":{"unit":"deg"},"button_background_gradient_position":"center center","button_background_image":{"url":"","id":"","size":""},"button_background_image_tablet":{"url":"","id":"","size":""},"button_background_image_mobile":{"url":"","id":"","size":""},"button_background_position":"","button_background_position_tablet":"","button_background_position_mobile":"","button_background_xpos":{"unit":"px","size":0,"sizes":[]},"button_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"button_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"button_background_ypos":{"unit":"px","size":0,"sizes":[]},"button_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"button_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"button_background_attachment":"","button_background_repeat":"","button_background_repeat_tablet":"","button_background_repeat_mobile":"","button_background_size":"","button_background_size_tablet":"","button_background_size_mobile":"","button_background_bg_width":{"unit":"%","size":100,"sizes":[]},"button_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"button_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"button_background_video_link":"","button_background_video_start":"","button_background_video_end":"","button_background_play_once":"","button_background_play_on_mobile":"","button_background_privacy_mode":"","button_background_video_fallback":{"url":"","id":"","size":""},"button_background_slideshow_gallery":[],"button_background_slideshow_loop":"yes","button_background_slideshow_slide_duration":5000,"button_background_slideshow_slide_transition":"fade","button_background_slideshow_transition_duration":500,"button_background_slideshow_background_size":"","button_background_slideshow_background_size_tablet":"","button_background_slideshow_background_size_mobile":"","button_background_slideshow_background_position":"","button_background_slideshow_background_position_tablet":"","button_background_slideshow_background_position_mobile":"","button_background_slideshow_lazyload":"","button_background_slideshow_ken_burns":"","button_background_slideshow_ken_burns_zoom_direction":"in","button_border_width":{"unit":"px","top":3,"right":3,"bottom":3,"left":3,"isLinked":true},"button_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_border_color":"#666","advanced_button_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_shadow_box_shadow_type":"","advanced_button_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"advanced_button_shadow_box_shadow_position":" ","advanced_button_typography_typography":"","advanced_button_typography_font_family":"","advanced_button_typography_font_size":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_font_size_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_font_size_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_font_weight":"","advanced_button_typography_text_transform":"","advanced_button_typography_font_style":"","advanced_button_typography_text_decoration":"","advanced_button_typography_line_height":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_line_height_tablet":{"unit":"em","size":"","sizes":[]},"advanced_button_typography_line_height_mobile":{"unit":"em","size":"","sizes":[]},"advanced_button_typography_letter_spacing":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_letter_spacing_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_letter_spacing_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_word_spacing":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_word_spacing_tablet":{"unit":"em","size":"","sizes":[]},"advanced_button_typography_word_spacing_mobile":{"unit":"em","size":"","sizes":[]},"button_width":{"unit":"px","size":"","sizes":[]},"button_width_tablet":{"unit":"px","size":"","sizes":[]},"button_width_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_hover_text_color":"","button_hover_background_gradient_notice":"","button_hover_background_color":"","button_hover_background_color_stop":{"unit":"%","size":0,"sizes":[]},"button_hover_background_color_stop_tablet":{"unit":"%"},"button_hover_background_color_stop_mobile":{"unit":"%"},"button_hover_background_color_b":"#f2295b","button_hover_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"button_hover_background_color_b_stop_tablet":{"unit":"%"},"button_hover_background_color_b_stop_mobile":{"unit":"%"},"button_hover_background_gradient_type":"linear","button_hover_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"button_hover_background_gradient_angle_tablet":{"unit":"deg"},"button_hover_background_gradient_angle_mobile":{"unit":"deg"},"button_hover_background_gradient_position":"center center","button_hover_background_image":{"url":"","id":"","size":""},"button_hover_background_image_tablet":{"url":"","id":"","size":""},"button_hover_background_image_mobile":{"url":"","id":"","size":""},"button_hover_background_position":"","button_hover_background_position_tablet":"","button_hover_background_position_mobile":"","button_hover_background_xpos":{"unit":"px","size":0,"sizes":[]},"button_hover_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"button_hover_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"button_hover_background_ypos":{"unit":"px","size":0,"sizes":[]},"button_hover_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"button_hover_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"button_hover_background_attachment":"","button_hover_background_repeat":"","button_hover_background_repeat_tablet":"","button_hover_background_repeat_mobile":"","button_hover_background_size":"","button_hover_background_size_tablet":"","button_hover_background_size_mobile":"","button_hover_background_bg_width":{"unit":"%","size":100,"sizes":[]},"button_hover_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"button_hover_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"button_hover_background_video_link":"","button_hover_background_video_start":"","button_hover_background_video_end":"","button_hover_background_play_once":"","button_hover_background_play_on_mobile":"","button_hover_background_privacy_mode":"","button_hover_background_video_fallback":{"url":"","id":"","size":""},"button_hover_background_slideshow_gallery":[],"button_hover_background_slideshow_loop":"yes","button_hover_background_slideshow_slide_duration":5000,"button_hover_background_slideshow_slide_transition":"fade","button_hover_background_slideshow_transition_duration":500,"button_hover_background_slideshow_background_size":"","button_hover_background_slideshow_background_size_tablet":"","button_hover_background_slideshow_background_size_mobile":"","button_hover_background_slideshow_background_position":"","button_hover_background_slideshow_background_position_tablet":"","button_hover_background_slideshow_background_position_mobile":"","button_hover_background_slideshow_lazyload":"","button_hover_background_slideshow_ken_burns":"","button_hover_background_slideshow_ken_burns_zoom_direction":"in","button_hover_border_width":{"unit":"px","top":3,"right":3,"bottom":3,"left":3,"isLinked":true},"button_hover_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_hover_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_hover_border_color":"","advanced_button_hover_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_hover_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_hover_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_hover_shadow_box_shadow_type":"","advanced_button_hover_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"advanced_button_hover_shadow_box_shadow_position":" ","hover_animation":"","advanced_button_icon_color":"","advanced_button_icon_background_background":"","advanced_button_icon_background_gradient_notice":"","advanced_button_icon_background_color":"","advanced_button_icon_background_color_stop":{"unit":"%","size":0,"sizes":[]},"advanced_button_icon_background_color_stop_tablet":{"unit":"%"},"advanced_button_icon_background_color_stop_mobile":{"unit":"%"},"advanced_button_icon_background_color_b":"#f2295b","advanced_button_icon_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_background_color_b_stop_tablet":{"unit":"%"},"advanced_button_icon_background_color_b_stop_mobile":{"unit":"%"},"advanced_button_icon_background_gradient_type":"linear","advanced_button_icon_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"advanced_button_icon_background_gradient_angle_tablet":{"unit":"deg"},"advanced_button_icon_background_gradient_angle_mobile":{"unit":"deg"},"advanced_button_icon_background_gradient_position":"center center","advanced_button_icon_background_image":{"url":"","id":"","size":""},"advanced_button_icon_background_image_tablet":{"url":"","id":"","size":""},"advanced_button_icon_background_image_mobile":{"url":"","id":"","size":""},"advanced_button_icon_background_position":"","advanced_button_icon_background_position_tablet":"","advanced_button_icon_background_position_mobile":"","advanced_button_icon_background_xpos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_ypos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_attachment":"","advanced_button_icon_background_repeat":"","advanced_button_icon_background_repeat_tablet":"","advanced_button_icon_background_repeat_mobile":"","advanced_button_icon_background_size":"","advanced_button_icon_background_size_tablet":"","advanced_button_icon_background_size_mobile":"","advanced_button_icon_background_bg_width":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_background_video_link":"","advanced_button_icon_background_video_start":"","advanced_button_icon_background_video_end":"","advanced_button_icon_background_play_once":"","advanced_button_icon_background_play_on_mobile":"","advanced_button_icon_background_privacy_mode":"","advanced_button_icon_background_video_fallback":{"url":"","id":"","size":""},"advanced_button_icon_background_slideshow_gallery":[],"advanced_button_icon_background_slideshow_loop":"yes","advanced_button_icon_background_slideshow_slide_duration":5000,"advanced_button_icon_background_slideshow_slide_transition":"fade","advanced_button_icon_background_slideshow_transition_duration":500,"advanced_button_icon_background_slideshow_background_size":"","advanced_button_icon_background_slideshow_background_size_tablet":"","advanced_button_icon_background_slideshow_background_size_mobile":"","advanced_button_icon_background_slideshow_background_position":"","advanced_button_icon_background_slideshow_background_position_tablet":"","advanced_button_icon_background_slideshow_background_position_mobile":"","advanced_button_icon_background_slideshow_lazyload":"","advanced_button_icon_background_slideshow_ken_burns":"","advanced_button_icon_background_slideshow_ken_burns_zoom_direction":"in","advanced_button_icon_border_border":"","advanced_button_icon_border_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_border_color":"","advanced_button_icon_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_padding":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_padding_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_shadow_box_shadow_type":"","advanced_button_icon_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"advanced_button_icon_shadow_box_shadow_position":" ","advanced_button_icon_size":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_size_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_size_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_hover_icon_color":"","advanced_button_icon_hover_background_background":"","advanced_button_icon_hover_background_gradient_notice":"","advanced_button_icon_hover_background_color":"","advanced_button_icon_hover_background_color_stop":{"unit":"%","size":0,"sizes":[]},"advanced_button_icon_hover_background_color_stop_tablet":{"unit":"%"},"advanced_button_icon_hover_background_color_stop_mobile":{"unit":"%"},"advanced_button_icon_hover_background_color_b":"#f2295b","advanced_button_icon_hover_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_hover_background_color_b_stop_tablet":{"unit":"%"},"advanced_button_icon_hover_background_color_b_stop_mobile":{"unit":"%"},"advanced_button_icon_hover_background_gradient_type":"linear","advanced_button_icon_hover_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"advanced_button_icon_hover_background_gradient_angle_tablet":{"unit":"deg"},"advanced_button_icon_hover_background_gradient_angle_mobile":{"unit":"deg"},"advanced_button_icon_hover_background_gradient_position":"center center","advanced_button_icon_hover_background_image":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_image_tablet":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_image_mobile":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_position":"","advanced_button_icon_hover_background_position_tablet":"","advanced_button_icon_hover_background_position_mobile":"","advanced_button_icon_hover_background_xpos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_ypos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_attachment":"","advanced_button_icon_hover_background_repeat":"","advanced_button_icon_hover_background_repeat_tablet":"","advanced_button_icon_hover_background_repeat_mobile":"","advanced_button_icon_hover_background_size":"","advanced_button_icon_hover_background_size_tablet":"","advanced_button_icon_hover_background_size_mobile":"","advanced_button_icon_hover_background_bg_width":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_hover_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_hover_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_hover_background_video_link":"","advanced_button_icon_hover_background_video_start":"","advanced_button_icon_hover_background_video_end":"","advanced_button_icon_hover_background_play_once":"","advanced_button_icon_hover_background_play_on_mobile":"","advanced_button_icon_hover_background_privacy_mode":"","advanced_button_icon_hover_background_video_fallback":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_slideshow_gallery":[],"advanced_button_icon_hover_background_slideshow_loop":"yes","advanced_button_icon_hover_background_slideshow_slide_duration":5000,"advanced_button_icon_hover_background_slideshow_slide_transition":"fade","advanced_button_icon_hover_background_slideshow_transition_duration":500,"advanced_button_icon_hover_background_slideshow_background_size":"","advanced_button_icon_hover_background_slideshow_background_size_tablet":"","advanced_button_icon_hover_background_slideshow_background_size_mobile":"","advanced_button_icon_hover_background_slideshow_background_position":"","advanced_button_icon_hover_background_slideshow_background_position_tablet":"","advanced_button_icon_hover_background_slideshow_background_position_mobile":"","advanced_button_icon_hover_background_slideshow_lazyload":"","advanced_button_icon_hover_background_slideshow_ken_burns":"","advanced_button_icon_hover_background_slideshow_ken_burns_zoom_direction":"in","icon_hover_border_color":"","badge_color":"","badge_background_background":"","badge_background_gradient_notice":"","badge_background_color":"","badge_background_color_stop":{"unit":"%","size":0,"sizes":[]},"badge_background_color_stop_tablet":{"unit":"%"},"badge_background_color_stop_mobile":{"unit":"%"},"badge_background_color_b":"#f2295b","badge_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"badge_background_color_b_stop_tablet":{"unit":"%"},"badge_background_color_b_stop_mobile":{"unit":"%"},"badge_background_gradient_type":"linear","badge_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"badge_background_gradient_angle_tablet":{"unit":"deg"},"badge_background_gradient_angle_mobile":{"unit":"deg"},"badge_background_gradient_position":"center center","badge_background_image":{"url":"","id":"","size":""},"badge_background_image_tablet":{"url":"","id":"","size":""},"badge_background_image_mobile":{"url":"","id":"","size":""},"badge_background_position":"","badge_background_position_tablet":"","badge_background_position_mobile":"","badge_background_xpos":{"unit":"px","size":0,"sizes":[]},"badge_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_background_ypos":{"unit":"px","size":0,"sizes":[]},"badge_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_background_attachment":"","badge_background_repeat":"","badge_background_repeat_tablet":"","badge_background_repeat_mobile":"","badge_background_size":"","badge_background_size_tablet":"","badge_background_size_mobile":"","badge_background_bg_width":{"unit":"%","size":100,"sizes":[]},"badge_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"badge_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"badge_background_video_link":"","badge_background_video_start":"","badge_background_video_end":"","badge_background_play_once":"","badge_background_play_on_mobile":"","badge_background_privacy_mode":"","badge_background_video_fallback":{"url":"","id":"","size":""},"badge_background_slideshow_gallery":[],"badge_background_slideshow_loop":"yes","badge_background_slideshow_slide_duration":5000,"badge_background_slideshow_slide_transition":"fade","badge_background_slideshow_transition_duration":500,"badge_background_slideshow_background_size":"","badge_background_slideshow_background_size_tablet":"","badge_background_slideshow_background_size_mobile":"","badge_background_slideshow_background_position":"","badge_background_slideshow_background_position_tablet":"","badge_background_slideshow_background_position_mobile":"","badge_background_slideshow_lazyload":"","badge_background_slideshow_ken_burns":"","badge_background_slideshow_ken_burns_zoom_direction":"in","badge_border_border":"","badge_border_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_border_color":"","badge_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_padding":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_padding_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_shadow_box_shadow_type":"","badge_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"badge_shadow_box_shadow_position":" ","badge_typography_typography":"","badge_typography_font_family":"","badge_typography_font_size":{"unit":"px","size":"","sizes":[]},"badge_typography_font_size_tablet":{"unit":"px","size":"","sizes":[]},"badge_typography_font_size_mobile":{"unit":"px","size":"","sizes":[]},"badge_typography_font_weight":"","badge_typography_text_transform":"","badge_typography_font_style":"","badge_typography_text_decoration":"","badge_typography_line_height":{"unit":"px","size":"","sizes":[]},"badge_typography_line_height_tablet":{"unit":"em","size":"","sizes":[]},"badge_typography_line_height_mobile":{"unit":"em","size":"","sizes":[]},"badge_typography_letter_spacing":{"unit":"px","size":"","sizes":[]},"badge_typography_letter_spacing_tablet":{"unit":"px","size":"","sizes":[]},"badge_typography_letter_spacing_mobile":{"unit":"px","size":"","sizes":[]},"badge_typography_word_spacing":{"unit":"px","size":"","sizes":[]},"badge_typography_word_spacing_tablet":{"unit":"em","size":"","sizes":[]},"badge_typography_word_spacing_mobile":{"unit":"em","size":"","sizes":[]},"badge_hover_icon_color":"","badge_hover_background_background":"","badge_hover_background_gradient_notice":"","badge_hover_background_color":"","badge_hover_background_color_stop":{"unit":"%","size":0,"sizes":[]},"badge_hover_background_color_stop_tablet":{"unit":"%"},"badge_hover_background_color_stop_mobile":{"unit":"%"},"badge_hover_background_color_b":"#f2295b","badge_hover_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"badge_hover_background_color_b_stop_tablet":{"unit":"%"},"badge_hover_background_color_b_stop_mobile":{"unit":"%"},"badge_hover_background_gradient_type":"linear","badge_hover_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"badge_hover_background_gradient_angle_tablet":{"unit":"deg"},"badge_hover_background_gradient_angle_mobile":{"unit":"deg"},"badge_hover_background_gradient_position":"center center","badge_hover_background_image":{"url":"","id":"","size":""},"badge_hover_background_image_tablet":{"url":"","id":"","size":""},"badge_hover_background_image_mobile":{"url":"","id":"","size":""},"badge_hover_background_position":"","badge_hover_background_position_tablet":"","badge_hover_background_position_mobile":"","badge_hover_background_xpos":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_ypos":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_attachment":"","badge_hover_background_repeat":"","badge_hover_background_repeat_tablet":"","badge_hover_background_repeat_mobile":"","badge_hover_background_size":"","badge_hover_background_size_tablet":"","badge_hover_background_size_mobile":"","badge_hover_background_bg_width":{"unit":"%","size":100,"sizes":[]},"badge_hover_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"badge_hover_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"badge_hover_background_video_link":"","badge_hover_background_video_start":"","badge_hover_background_video_end":"","badge_hover_background_play_once":"","badge_hover_background_play_on_mobile":"","badge_hover_background_privacy_mode":"","badge_hover_background_video_fallback":{"url":"","id":"","size":""},"badge_hover_background_slideshow_gallery":[],"badge_hover_background_slideshow_loop":"yes","badge_hover_background_slideshow_slide_duration":5000,"badge_hover_background_slideshow_slide_transition":"fade","badge_hover_background_slideshow_transition_duration":500,"badge_hover_background_slideshow_background_size":"","badge_hover_background_slideshow_background_size_tablet":"","badge_hover_background_slideshow_background_size_mobile":"","badge_hover_background_slideshow_background_position":"","badge_hover_background_slideshow_background_position_tablet":"","badge_hover_background_slideshow_background_position_mobile":"","badge_hover_background_slideshow_lazyload":"","badge_hover_background_slideshow_ken_burns":"","badge_hover_background_slideshow_ken_burns_zoom_direction":"in","badge_hover_border_color":"","_title":"","_margin":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_margin_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_margin_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_padding":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_padding_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_element_width":"","_element_width_tablet":"","_element_width_mobile":"","_element_custom_width":{"unit":"%","size":"","sizes":[]},"_element_custom_width_tablet":{"unit":"px","size":"","sizes":[]},"_element_custom_width_mobile":{"unit":"px","size":"","sizes":[]},"_element_vertical_align":"","_element_vertical_align_tablet":"","_element_vertical_align_mobile":"","_position_description":"","_position":"","_offset_orientation_h":"start","_offset_x":{"unit":"px","size":0,"sizes":[]},"_offset_x_tablet":{"unit":"px","size":"","sizes":[]},"_offset_x_mobile":{"unit":"px","size":"","sizes":[]},"_offset_x_end":{"unit":"px","size":0,"sizes":[]},"_offset_x_end_tablet":{"unit":"px","size":"","sizes":[]},"_offset_x_end_mobile":{"unit":"px","size":"","sizes":[]},"_offset_orientation_v":"start","_offset_y":{"unit":"px","size":0,"sizes":[]},"_offset_y_tablet":{"unit":"px","size":"","sizes":[]},"_offset_y_mobile":{"unit":"px","size":"","sizes":[]},"_offset_y_end":{"unit":"px","size":0,"sizes":[]},"_offset_y_end_tablet":{"unit":"px","size":"","sizes":[]},"_offset_y_end_mobile":{"unit":"px","size":"","sizes":[]},"_z_index":"","_z_index_tablet":"","_z_index_mobile":"","_element_id":"","_css_classes":"","wcm_element_visibility_condition":"visible_to_everyone","wcm_element_visibility_show_plans":["wcm-all"],"wcm_element_visibility_hide_plans":["wcm-none"],"wcm_element_visibility_show_content_restricted_message":"","ep_widget_cf_confetti":"","ep_widget_cf_type":"basic","ep_widget_cf_fireworks_duration":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_anim_infinite":"","ep_widget_cf_particle_count":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_start_velocity":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_spread":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_angle":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_shape_type":"basic","ep_widget_cf_scalar":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_origin":"","ep_widget_cf_origin_x":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_origin_y":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_trigger_type":"load","ep_widget_cf_trigger_selector":"","ep_widget_cf_trigger_delay":{"unit":"px","size":3000,"sizes":[]},"ep_widget_cf_z_index":"","ep_display_conditions_enable":"","ep_display_conditions_to":"show","ep_display_conditions_relation":"all","ep_floating_effects_show":"","ep_floating_effects_translate_toggle":"","ep_floating_effects_translate_x":{"unit":"px","size":"","sizes":{"from":0,"to":0}},"ep_floating_effects_translate_y":{"unit":"px","size":"","sizes":{"from":0,"to":30}},"ep_floating_effects_translate_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_translate_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_rotate_toggle":"","ep_floating_effects_rotate_x":{"unit":"deg","size":"","sizes":{"from":0,"to":0}},"ep_floating_effects_rotate_y":{"unit":"deg","size":"","sizes":{"from":0,"to":0}},"ep_floating_effects_rotate_z":{"unit":"deg","size":"","sizes":{"from":0,"to":45}},"ep_floating_effects_rotate_infinite":"","ep_floating_effects_rotate_duration":{"unit":"px","size":2000,"sizes":[]},"ep_floating_effects_rotate_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_scale_toggle":"","ep_floating_effects_scale_x":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_scale_y":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_scale_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_scale_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_skew_toggle":"","ep_floating_effects_skew_x":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_skew_y":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_skew_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_skew_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_border_radius_toggle":"","ep_floating_effects_border_radius":{"unit":"px","size":"","sizes":{"from":0,"to":50}},"ep_floating_effects_border_radius_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_border_radius_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_opacity_toggle":"","ep_floating_effects_opacity_start":{"unit":"px","size":1,"sizes":[]},"ep_floating_effects_opacity_end":{"unit":"px","size":0,"sizes":[]},"ep_floating_effects_opacity_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_easing":"easeInOutQuad","ep_parallax_effects_show":"","ep_parallax_effects_x":"","ep_parallax_effects_x_start":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_x_end":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_x_custom_show":"","ep_parallax_effects_x_custom_value":"","ep_parallax_effects_y":"","ep_parallax_effects_y_start":{"unit":"px","size":50,"sizes":[]},"ep_parallax_effects_y_end":{"unit":"px","size":0,"sizes":[]},"ep_parallax_effects_y_custom_show":"","ep_parallax_effects_y_custom_value":"","ep_parallax_effects_opacity_toggole":"","ep_parallax_effects_opacity":"","ep_parallax_effects_opacity_custom_show":"","ep_parallax_effects_opacity_custom_value":"","ep_parallax_effects_blur":"","ep_parallax_effects_blur_start":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_blur_end":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_rotate":"","ep_parallax_effects_rotate_start":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_rotate_end":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_scale":"","ep_parallax_effects_scale_start":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_scale_end":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_hue":"","ep_parallax_effects_hue_value":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_sepia":"","ep_parallax_effects_sepia_value":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_easing":"","ep_parallax_effects_easing_value":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_transition":"","ep_parallax_effects_viewport":"","ep_parallax_effects_viewport_start":"","ep_parallax_effects_viewport_end":"","ep_parallax_effects_media_query":"","ep_parallax_effects_target":"self","motion_fx_motion_fx_scrolling":"","motion_fx_translateY_effect":"","motion_fx_translateY_direction":"","motion_fx_translateY_speed":{"unit":"px","size":4,"sizes":[]},"motion_fx_translateY_affectedRange":{"unit":"%","size":"","sizes":{"start":0,"end":100}},"motion_fx_translateX_effect":"","motion_fx_translateX_direction":"","motion_fx_translateX_speed":{"unit":"px","size":4,"sizes":[]},"motion_fx_translateX_affectedRange":{"unit":"%","size":"","sizes":{"start":0,"end":100}},"motion_fx_opacity_effect":"","motion_fx_opacity_direction":"out-in","motion_fx_opacity_level":{"unit":"px","size":10,"sizes":[]},"motion_fx_opacity_range":{"unit":"%","size":"","sizes":{"start":20,"end":80}},"motion_fx_blur_effect":"","motion_fx_blur_direction":"out-in","motion_fx_blur_level":{"unit":"px","size":7,"sizes":[]},"motion_fx_blur_range":{"unit":"%","size":"","sizes":{"start":20,"end":80}},"motion_fx_rotateZ_effect":"","motion_fx_rotateZ_direction":"","motion_fx_rotateZ_speed":{"unit":"px","size":1,"sizes":[]},"motion_fx_rotateZ_affectedRange":{"unit":"%","size":"","sizes":{"start":0,"end":100}},"motion_fx_scale_effect":"","motion_fx_scale_direction":"out-in","motion_fx_scale_speed":{"unit":"px","size":4,"sizes":[]},"motion_fx_scale_range":{"unit":"%","size":"","sizes":{"start":20,"end":80}},"motion_fx_transform_origin_x":"center","motion_fx_transform_origin_y":"center","motion_fx_devices":["desktop","tablet","mobile"],"motion_fx_range":"","motion_fx_motion_fx_mouse":"","motion_fx_mouseTrack_effect":"","motion_fx_mouseTrack_direction":"","motion_fx_mouseTrack_speed":{"unit":"px","size":1,"sizes":[]},"motion_fx_tilt_effect":"","motion_fx_tilt_direction":"","motion_fx_tilt_speed":{"unit":"px","size":4,"sizes":[]},"sticky":"","sticky_on":["desktop","tablet","mobile"],"sticky_offset":0,"sticky_offset_tablet":"","sticky_offset_mobile":"","sticky_effects_offset":0,"sticky_effects_offset_tablet":"","sticky_effects_offset_mobile":"","sticky_parent":"","_animation":"","_animation_tablet":"","_animation_mobile":"","animation_duration":"","_animation_delay":"","_transform_rotate_popover":"","_transform_rotateZ_effect":{"unit":"px","size":"","sizes":[]},"_transform_rotateZ_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateZ_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotate_3d":"","_transform_rotateX_effect":{"unit":"px","size":"","sizes":[]},"_transform_rotateX_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateX_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect":{"unit":"px","size":"","sizes":[]},"_transform_rotateY_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_perspective_effect":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translate_popover":"","_transform_translateX_effect":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scale_popover":"","_transform_keep_proportions":"yes","_transform_scale_effect":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_skew_popover":"","_transform_skewX_effect":{"unit":"px","size":"","sizes":[]},"_transform_skewX_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewX_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect":{"unit":"px","size":"","sizes":[]},"_transform_skewY_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_flipX_effect":"","_transform_flipY_effect":"","_transform_rotate_popover_hover":"","_transform_rotateZ_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_rotateZ_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateZ_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotate_3d_hover":"","_transform_rotateX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_rotateX_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateX_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_rotateY_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_perspective_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translate_popover_hover":"","_transform_translateX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scale_popover_hover":"","_transform_keep_proportions_hover":"yes","_transform_scale_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_skew_popover_hover":"","_transform_skewX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_skewX_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewX_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_skewY_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_flipX_effect_hover":"","_transform_flipY_effect_hover":"","_transform_transition_hover":{"unit":"px","size":"","sizes":[]},"motion_fx_transform_x_anchor_point":"","motion_fx_transform_x_anchor_point_tablet":"","motion_fx_transform_x_anchor_point_mobile":"","motion_fx_transform_y_anchor_point":"","motion_fx_transform_y_anchor_point_tablet":"","motion_fx_transform_y_anchor_point_mobile":"","_background_background":"","_background_gradient_notice":"","_background_color":"","_background_color_stop":{"unit":"%","size":0,"sizes":[]},"_background_color_stop_tablet":{"unit":"%"},"_background_color_stop_mobile":{"unit":"%"},"_background_color_b":"#f2295b","_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"_background_color_b_stop_tablet":{"unit":"%"},"_background_color_b_stop_mobile":{"unit":"%"},"_background_gradient_type":"linear","_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"_background_gradient_angle_tablet":{"unit":"deg"},"_background_gradient_angle_mobile":{"unit":"deg"},"_background_gradient_position":"center center","_background_image":{"url":"","id":"","size":""},"_background_image_tablet":{"url":"","id":"","size":""},"_background_image_mobile":{"url":"","id":"","size":""},"_background_position":"","_background_position_tablet":"","_background_position_mobile":"","_background_xpos":{"unit":"px","size":0,"sizes":[]},"_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_ypos":{"unit":"px","size":0,"sizes":[]},"_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_attachment":"","_background_repeat":"","_background_repeat_tablet":"","_background_repeat_mobile":"","_background_size":"","_background_size_tablet":"","_background_size_mobile":"","_background_bg_width":{"unit":"%","size":100,"sizes":[]},"_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"_background_video_link":"","_background_video_start":"","_background_video_end":"","_background_play_once":"","_background_play_on_mobile":"","_background_privacy_mode":"","_background_video_fallback":{"url":"","id":"","size":""},"_background_slideshow_gallery":[],"_background_slideshow_loop":"yes","_background_slideshow_slide_duration":5000,"_background_slideshow_slide_transition":"fade","_background_slideshow_transition_duration":500,"_background_slideshow_background_size":"","_background_slideshow_background_size_tablet":"","_background_slideshow_background_size_mobile":"","_background_slideshow_background_position":"","_background_slideshow_background_position_tablet":"","_background_slideshow_background_position_mobile":"","_background_slideshow_lazyload":"","_background_slideshow_ken_burns":"","_background_slideshow_ken_burns_zoom_direction":"in","_background_hover_background":"","_background_hover_gradient_notice":"","_background_hover_color":"","_background_hover_color_stop":{"unit":"%","size":0,"sizes":[]},"_background_hover_color_stop_tablet":{"unit":"%"},"_background_hover_color_stop_mobile":{"unit":"%"},"_background_hover_color_b":"#f2295b","_background_hover_color_b_stop":{"unit":"%","size":100,"sizes":[]},"_background_hover_color_b_stop_tablet":{"unit":"%"},"_background_hover_color_b_stop_mobile":{"unit":"%"},"_background_hover_gradient_type":"linear","_background_hover_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"_background_hover_gradient_angle_tablet":{"unit":"deg"},"_background_hover_gradient_angle_mobile":{"unit":"deg"},"_background_hover_gradient_position":"center center","_background_hover_image":{"url":"","id":"","size":""},"_background_hover_image_tablet":{"url":"","id":"","size":""},"_background_hover_image_mobile":{"url":"","id":"","size":""},"_background_hover_position":"","_background_hover_position_tablet":"","_background_hover_position_mobile":"","_background_hover_xpos":{"unit":"px","size":0,"sizes":[]},"_background_hover_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_hover_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_hover_ypos":{"unit":"px","size":0,"sizes":[]},"_background_hover_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_hover_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_hover_attachment":"","_background_hover_repeat":"","_background_hover_repeat_tablet":"","_background_hover_repeat_mobile":"","_background_hover_size":"","_background_hover_size_tablet":"","_background_hover_size_mobile":"","_background_hover_bg_width":{"unit":"%","size":100,"sizes":[]},"_background_hover_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"_background_hover_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"_background_hover_video_link":"","_background_hover_video_start":"","_background_hover_video_end":"","_background_hover_play_once":"","_background_hover_play_on_mobile":"","_background_hover_privacy_mode":"","_background_hover_video_fallback":{"url":"","id":"","size":""},"_background_hover_slideshow_gallery":[],"_background_hover_slideshow_loop":"yes","_background_hover_slideshow_slide_duration":5000,"_background_hover_slideshow_slide_transition":"fade","_background_hover_slideshow_transition_duration":500,"_background_hover_slideshow_background_size":"","_background_hover_slideshow_background_size_tablet":"","_background_hover_slideshow_background_size_mobile":"","_background_hover_slideshow_background_position":"","_background_hover_slideshow_background_position_tablet":"","_background_hover_slideshow_background_position_mobile":"","_background_hover_slideshow_lazyload":"","_background_hover_slideshow_ken_burns":"","_background_hover_slideshow_ken_burns_zoom_direction":"in","_background_hover_transition":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_background":"","ep_background_overlay_gradient_notice":"","ep_background_overlay_color":"","ep_background_overlay_color_stop":{"unit":"%","size":0,"sizes":[]},"ep_background_overlay_color_stop_tablet":{"unit":"%"},"ep_background_overlay_color_stop_mobile":{"unit":"%"},"ep_background_overlay_color_b":"#f2295b","ep_background_overlay_color_b_stop":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_color_b_stop_tablet":{"unit":"%"},"ep_background_overlay_color_b_stop_mobile":{"unit":"%"},"ep_background_overlay_gradient_type":"linear","ep_background_overlay_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"ep_background_overlay_gradient_angle_tablet":{"unit":"deg"},"ep_background_overlay_gradient_angle_mobile":{"unit":"deg"},"ep_background_overlay_gradient_position":"center center","ep_background_overlay_image":{"url":"","id":"","size":""},"ep_background_overlay_image_tablet":{"url":"","id":"","size":""},"ep_background_overlay_image_mobile":{"url":"","id":"","size":""},"ep_background_overlay_position":"","ep_background_overlay_position_tablet":"","ep_background_overlay_position_mobile":"","ep_background_overlay_xpos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_ypos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_attachment":"","ep_background_overlay_repeat":"","ep_background_overlay_repeat_tablet":"","ep_background_overlay_repeat_mobile":"","ep_background_overlay_size":"","ep_background_overlay_size_tablet":"","ep_background_overlay_size_mobile":"","ep_background_overlay_bg_width":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_video_link":"","ep_background_overlay_video_start":"","ep_background_overlay_video_end":"","ep_background_overlay_play_once":"","ep_background_overlay_play_on_mobile":"","ep_background_overlay_privacy_mode":"","ep_background_overlay_video_fallback":{"url":"","id":"","size":""},"ep_background_overlay_slideshow_gallery":[],"ep_background_overlay_slideshow_loop":"yes","ep_background_overlay_slideshow_slide_duration":5000,"ep_background_overlay_slideshow_slide_transition":"fade","ep_background_overlay_slideshow_transition_duration":500,"ep_background_overlay_slideshow_background_size":"","ep_background_overlay_slideshow_background_size_tablet":"","ep_background_overlay_slideshow_background_size_mobile":"","ep_background_overlay_slideshow_background_position":"","ep_background_overlay_slideshow_background_position_tablet":"","ep_background_overlay_slideshow_background_position_mobile":"","ep_background_overlay_slideshow_lazyload":"","ep_background_overlay_slideshow_ken_burns":"","ep_background_overlay_slideshow_ken_burns_zoom_direction":"in","ep_background_overlay_opacity":{"unit":"px","size":0.5,"sizes":[]},"ep_css_filters_css_filter":"","ep_css_filters_blur":{"unit":"px","size":0,"sizes":[]},"ep_css_filters_brightness":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_contrast":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_saturate":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hue":{"unit":"px","size":0,"sizes":[]},"ep_overlay_blend_mode":"","ep_background_overlay_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_hover_background":"","ep_background_overlay_hover_gradient_notice":"","ep_background_overlay_hover_color":"","ep_background_overlay_hover_color_stop":{"unit":"%","size":0,"sizes":[]},"ep_background_overlay_hover_color_stop_tablet":{"unit":"%"},"ep_background_overlay_hover_color_stop_mobile":{"unit":"%"},"ep_background_overlay_hover_color_b":"#f2295b","ep_background_overlay_hover_color_b_stop":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_hover_color_b_stop_tablet":{"unit":"%"},"ep_background_overlay_hover_color_b_stop_mobile":{"unit":"%"},"ep_background_overlay_hover_gradient_type":"linear","ep_background_overlay_hover_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"ep_background_overlay_hover_gradient_angle_tablet":{"unit":"deg"},"ep_background_overlay_hover_gradient_angle_mobile":{"unit":"deg"},"ep_background_overlay_hover_gradient_position":"center center","ep_background_overlay_hover_image":{"url":"","id":"","size":""},"ep_background_overlay_hover_image_tablet":{"url":"","id":"","size":""},"ep_background_overlay_hover_image_mobile":{"url":"","id":"","size":""},"ep_background_overlay_hover_position":"","ep_background_overlay_hover_position_tablet":"","ep_background_overlay_hover_position_mobile":"","ep_background_overlay_hover_xpos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_ypos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_attachment":"","ep_background_overlay_hover_repeat":"","ep_background_overlay_hover_repeat_tablet":"","ep_background_overlay_hover_repeat_mobile":"","ep_background_overlay_hover_size":"","ep_background_overlay_hover_size_tablet":"","ep_background_overlay_hover_size_mobile":"","ep_background_overlay_hover_bg_width":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_hover_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_hover_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_hover_video_link":"","ep_background_overlay_hover_video_start":"","ep_background_overlay_hover_video_end":"","ep_background_overlay_hover_play_once":"","ep_background_overlay_hover_play_on_mobile":"","ep_background_overlay_hover_privacy_mode":"","ep_background_overlay_hover_video_fallback":{"url":"","id":"","size":""},"ep_background_overlay_hover_slideshow_gallery":[],"ep_background_overlay_hover_slideshow_loop":"yes","ep_background_overlay_hover_slideshow_slide_duration":5000,"ep_background_overlay_hover_slideshow_slide_transition":"fade","ep_background_overlay_hover_slideshow_transition_duration":500,"ep_background_overlay_hover_slideshow_background_size":"","ep_background_overlay_hover_slideshow_background_size_tablet":"","ep_background_overlay_hover_slideshow_background_size_mobile":"","ep_background_overlay_hover_slideshow_background_position":"","ep_background_overlay_hover_slideshow_background_position_tablet":"","ep_background_overlay_hover_slideshow_background_position_mobile":"","ep_background_overlay_hover_slideshow_lazyload":"","ep_background_overlay_hover_slideshow_ken_burns":"","ep_background_overlay_hover_slideshow_ken_burns_zoom_direction":"in","ep_background_overlay_hover_opacity":{"unit":"px","size":0.5,"sizes":[]},"ep_css_filters_hover_css_filter":"","ep_css_filters_hover_blur":{"unit":"px","size":0,"sizes":[]},"ep_css_filters_hover_brightness":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hover_contrast":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hover_saturate":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hover_hue":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_transition_duration":{"unit":"px","size":0.3,"sizes":[]},"ep_background_overlay_hover_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_hover_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_hover_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_margin":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_margin_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_margin_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_zindex":"","ep_background_overlay_position_relative":"","ep_background_overlay_widget_zindex":"-1","_border_border":"","_border_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_color":"","_border_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_box_shadow_box_shadow_type":"","_box_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"_box_shadow_box_shadow_position":" ","_border_hover_border":"","_border_hover_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_hover_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_hover_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_hover_color":"","_border_radius_hover":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_hover_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_hover_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_box_shadow_hover_box_shadow_type":"","_box_shadow_hover_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"_box_shadow_hover_box_shadow_position":" ","_border_hover_transition":{"unit":"px","size":"","sizes":[]},"_mask_switch":"","_mask_shape":"circle","_mask_image":{"url":"","id":"","size":""},"_mask_notice":"","_mask_size":"contain","_mask_size_tablet":"","_mask_size_mobile":"","_mask_size_scale":{"unit":"%","size":100,"sizes":[]},"_mask_size_scale_tablet":{"unit":"px","size":"","sizes":[]},"_mask_size_scale_mobile":{"unit":"px","size":"","sizes":[]},"_mask_position":"center center","_mask_position_tablet":"","_mask_position_mobile":"","_mask_position_x":{"unit":"%","size":0,"sizes":[]},"_mask_position_x_tablet":{"unit":"px","size":"","sizes":[]},"_mask_position_x_mobile":{"unit":"px","size":"","sizes":[]},"_mask_position_y":{"unit":"%","size":0,"sizes":[]},"_mask_position_y_tablet":{"unit":"px","size":"","sizes":[]},"_mask_position_y_mobile":{"unit":"px","size":"","sizes":[]},"_mask_repeat":"no-repeat","_mask_repeat_tablet":"","_mask_repeat_mobile":"","hide_desktop":"","hide_tablet":"","hide_mobile":"","_attributes":"","custom_css":""},"defaultEditSettings":{"defaultEditRoute":"content"},"elements":[],"widgetType":"bdt-advanced-button","editSettings":{"defaultEditRoute":"content"},"htmlCache":""}]}](https://consultorsalud.com/wp-content/uploads/2024/03/1080x1080_portal_central-de-mezclas_01-1.jpg)
