- PUBLICADO:
Salvamento a Coomeva EPS – Supersalud aprueba plan de recuperación financiera

Escucha esta noticia
Cargando audio...
Para nadie es un secreto la profunda crisis que atraviesa Coomeva EPS, pero especialmente el lamentable estado asistencial que ofrece en muchos lugares de la geografía colombiana, producto en buen parte de la ausencia de una red de prestadores de servicios de salud que colme las necesidades de sus millones de afiliados, que se niegan a prestar servicios o se retiran de su red, por la creciente cartera y el incumplimiento de los acuerdos de pago realizados previamente.
En el momento mas crítico de su operación como EPS, la Superintendencia Nacional de Salud le ofrece a Coomeva un salvavidas, al aprobarle su plan de recuperación financiera que se extiende hasta el año 2024.
A continuación, CONSULTORSALUD te presenta los principales componentes de este ambicioso plan de recuperación, de una de las EPS mas grandes con que cuenta el sistema de salud, y que está registrado en la resolución 011687 del 2018.
La génesis del mejoramiento esperado en Coomeva EPS
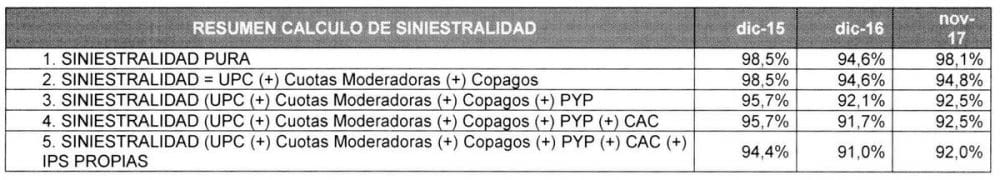
El inicio de la implementación de las estrategias tanto para el fortalecimiento del modelo de salud y como el mejoramiento de los resultados del costo médico, han permitido que Ia siniestralidad del costo POS el año 2017 este por el orden del 92.29% y Ia del costo total (incluyo POS, NO POS y Prestaciones Económicas) en 93.65%, lo cual muestra un avance frente a lo observado al cierre del 2016, año en el que cerró con una siniestralidad POS de 92.32% y un costo total de 95.19%.
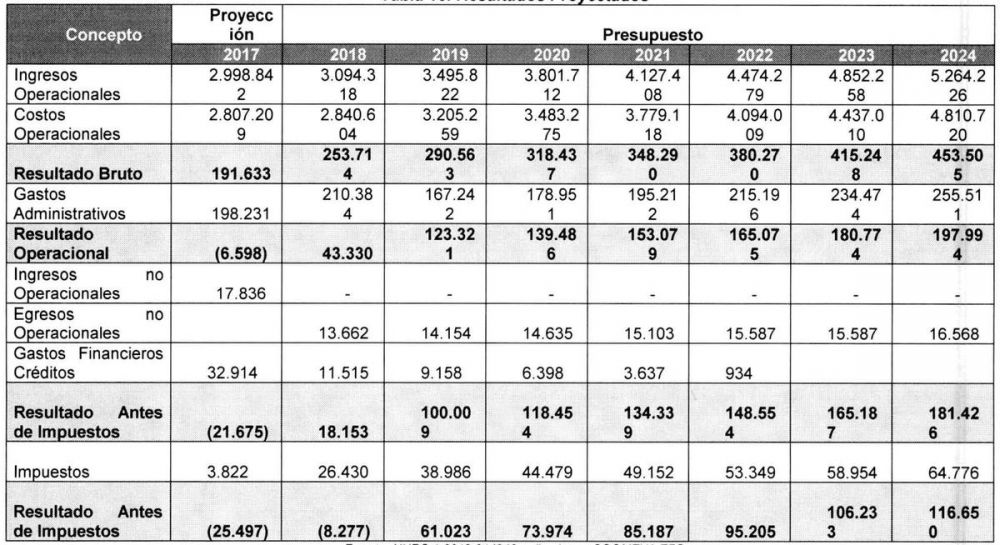
Esto gracias a importantes cambios de Ia entidad en lo que refiere a su gobierno corporativo, concentración de su operación, gestión de ingresos, gastos y costos, entre otros, los cuales permitirán cerrar el año 2017 con un cumplimiento de Ia meta presupuestada. Por su parte, para el año 2018 se proyectaron resultados positivos con un cierre de $18,153 millones de utilidad neta y una siniestralidad POS del 90.5% que impactarán positivamente la Iiquidez y el patrimonio.
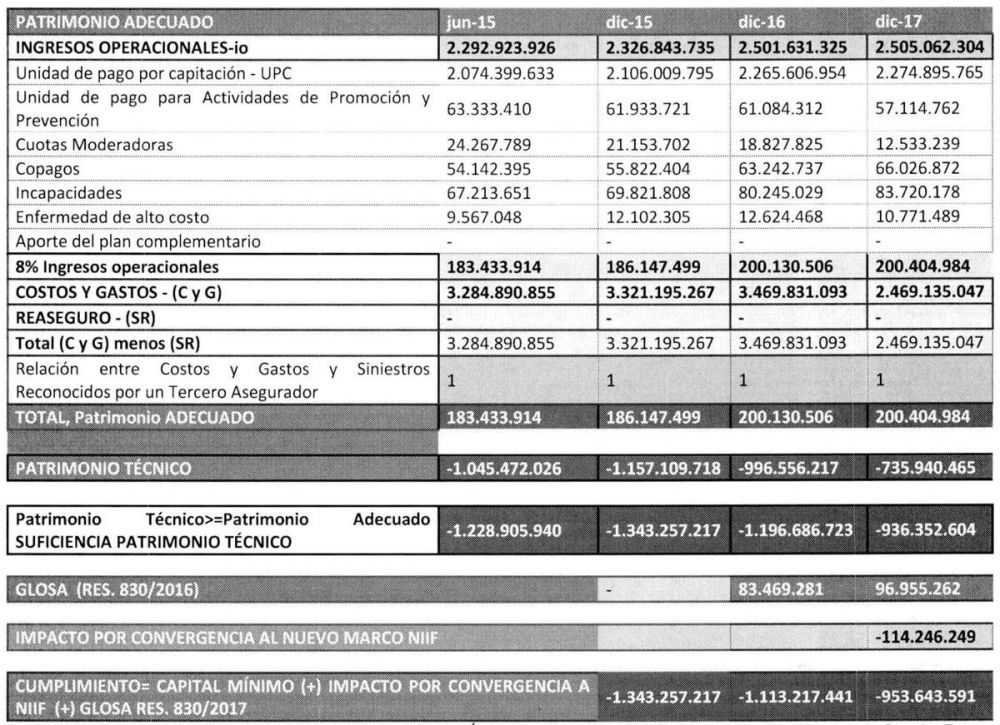
Supuestos Implementados en el Plan de Ajuste y Recuperación Financiera que contiene la resolución 011687 del 2018.
En el documento plan sustantivo de presupuesto, COOMEVA EPS presenta el siguiente resumen de los indicadores de las proyecciones financieras:
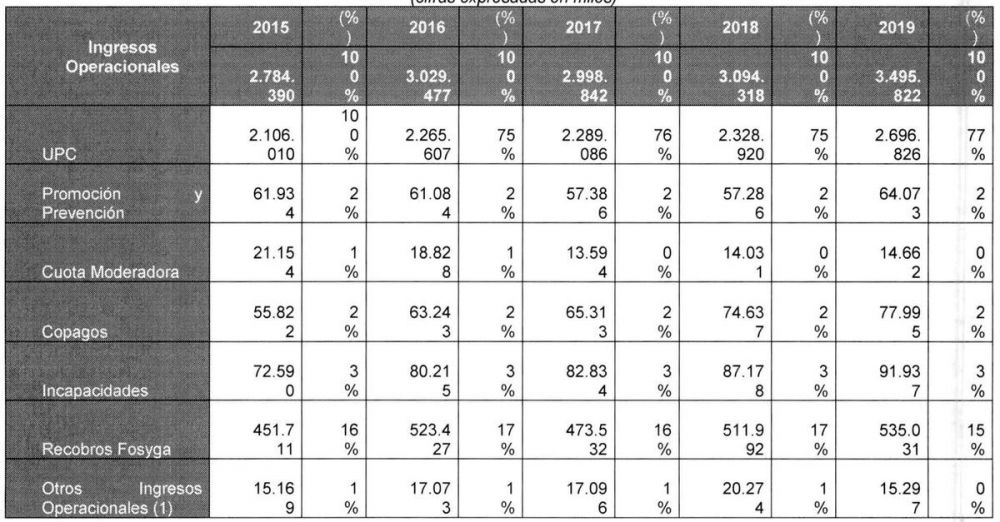
Proyección de ingresos de Coomeva EPS
Resumen cálculo de siniestralidad Coomeva EPS
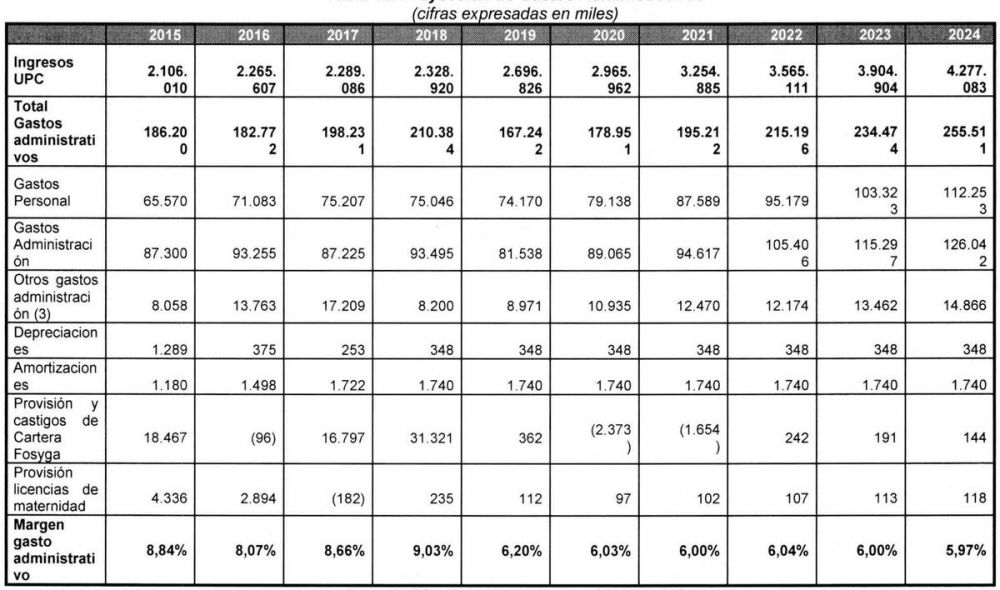
Proyección de gastos administrativos Coomeva EPS
Resultados proyectados Coomeva EPS
Plan de Capitalizaciones de Coomeva EPS
COOMEVA EPS en su modelo financiero propone el siguiente plan de capitalizaciones:
“Capitalizaciones (de recursos líquidos y acreencias) adicionales por $443,000 millones entre el 2018. Para el año 2018 $134,400 millones de capitalización a través de las siguientes fuentes:
- Capitalización de Coomeva: Nuevos aportes de capital hasta por los $42,400 millones, con los cuales se espera hacer pagos a Ia red de salud y buscar descuentos de cartera.
- Aliados estratégicos: A través de suscripciones de bonos o capitalizaciones por vía de compra/endoso de cartera y/o capitalización por $42,000 millones.
- Otros Acreedores: Capitalizaciones adicionales de acreencias hasta por $50.000 millones, de forma que se reduzca de manera proporcional el pasivo.
Para el año 2019 capitalización por $123,000 millones y un saldo al cierre de ese mismo año de $61.023 millones como anticipos para futuras capitalizaciones, que serán finalmente capitalizados en el año 2020, con el perfeccionamiento de la operación al realizar capitalizaciones por un total de $115,600 millones, a través de alternativas de inyección de capital directo o indirecto a través de fondos de capital fijo.
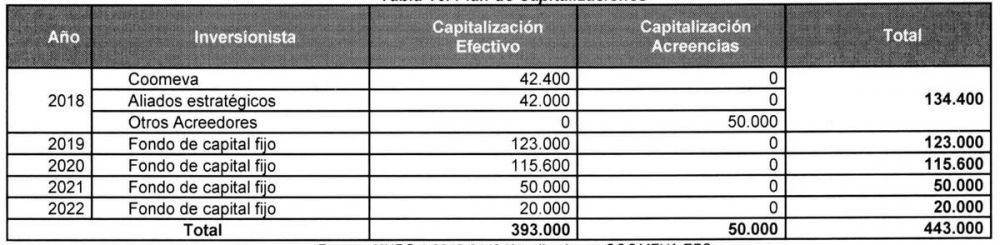
Para los años 2021 y 2022 se prevé capitalizaciones adicionales por un valor total de $70000 millones ($50,000 millones en el 2021 y $20,000 millones en el 2022) que se requieren para cubrir un capital temporal mientras las utilidades del ejercicio se van transfiriendo a los resultados de periodos anteriores, computando así en el capital primario.”
Mecanismos de pago contemplados por Coomeva EPS
COOMEVA en el Modelo de contratación contempla la entrega de incentivos por el buen desempeño a los prestadores que cumplan con estándares superiores a los pactados en materia de agregar valor a Ia salud de los afiliados asignados, los cuales son pactados en los contratos realizados y deberán estar financiados por Ia reducción de costos de no calidad que propicia Ia buena Gestion de los prestadores contratados bajo el esquema de riesgo compartido y pago por resultados.
De igual manera se contempla otorgar incentivos a los afiliados que demuestren pautas de comportamiento que vayan en pro del autocuidado, mejorar estilos de vida saludables y Ia adherencia a tratamientos. Dichos incentivos serán definidos dentro de los procesos de promoción y prevención de Ia empresa.
Por otra parte, menciona el Pago Prospectivo por Resultados, un valor fijo mensual definido según los servicios a con tratar y la carga enfermedad de la población objeto del contrato. La población objeto del contrato se relaciona por unidad básica de atención Población y Municipios asignados y los valores fijos mensuales estipulados se relacionan por cada unidad básica de atención. Un valor variable con forme a los resultados de los indicadores de salud que Coomeva EPS ha definido para el módulo de P y P y el Módulo Medico.
Concepto general de la Superintendencia Nacional de Salud
La Superintendencia Delegada para Ia Supervisión Institucional en apoyo de Ia Superintendencia Delegada para Ia Supervisión de Riesgos de acuerdo a lo conceptuado mediante memorando radicado bajo el NURC 3-2018-017750 de 26 de octubre de 2018, y la Dirección de Inspección y Vigilancia para las Entidades Administradoras de Planes de Beneficios, y previo análisis de Ia documentación radicada mediante comunicaciones relacionadas en Ia tabla número 1 del presente concepto y que hacen parte de los soportes para Ia evaluación del trámite solicitado, verificó que Ia solicitud de Plan de ajuste financiero especial presentado por COOMEVA EPS SA. Nit. 805000427, se ajusta a Ia normatividad vigente que rige este tipo de procedimientos dentro del Sisterna General de Seguridad Social en Salud —SGSSS-, emite CONCEPTO FAVORABLE de acuerdo con los requisitos exigidos en el artículo 2.5.2.2.1.17 Decreto 780 de 2016
Recomendaciones de la Supersalud a Coomeva EPS en la resolución 011687 del 2018
- APROBAR Ia solicitud de plan de ajuste financiero presentado por Ia ENTIDAD PROMOTORA DE SALUD COOMEVA EPS SA, en el sentido de acogerse a los plazos y tratamiento financiero especial en el marco del artículo 2.5.2.2.1.17 Decreto 780 de 2016.
- ADVERTIR a COOMEVA EPS SA, que frente el ingreso de nuevos capitales deberá realizar solicitud de aprobación previa ante Ia Superintendencia Nacional de Salud, pues constituyen dos actos diferentes, uno el presente Plan de Ajuste, y otro, el de Ia creación de nuevos estatutos, a partir de Ia entrada de nuevos socios, con sus respectivos capitales, pudiendo lie gar a modificar el porcentaje de participación de Ia sociedad comercial y Ia situación de control dentro de Ia misma.
- ORDENAR que, en los eventos de capitalización o ingreso de socios, inyección de capitales o similares y en general, cualquier actuación que realice la ENTIDAD PROMOTORA DE SALUD COOMEVA EPS SA, las mismas se ajusten y sigan cumpliendo lo establecido en Ia Circular Externa 009 de 2016 expedida por Ia Superintendencia Nacional de Salud, en lo que se refiere a implementación del SARLAFT.
NOTA DE CONSULTORSALUD:
Creemos que esta nueva condición de operacion de Coomeva EPS, no limitará su búsqueda de un inversionista mundial (España?) o nacional, que apoye de fondo la resolución de la situación financiera… seguiremos atentos.
Descargue la resolución 011687 del 2018 de la supersalud que aprueba el plan de recuperación financiera de Coomeva EPS desde el 2019
Documentos adjuntos
Este artículo tiene documentos adjuntos que podrá descargar para ampliar su información:

























![{"type":"elementor","siteurl":"https://consultorsalud.com/wp-json/","elements":[{"id":"37e6683","elType":"widget","isInner":false,"isLocked":false,"settings":{"text":"IR AL CURSO","link":{"url":"https://formarsalud.com/cursos/estrategias-para-el-saneamiento-financiero-de-ips-en-crisis/","is_external":"","nofollow":"","custom_attributes":""},"align":"center","badge_text":"Badge","button_effect":"c","advanced_button_text_color":"#FFFFFF","button_background_background":"classic","button_border_style":"none","button_hover_background_background":"classic","button_hover_border_style":"none","wcm_element_visibility_content_restricted_message":"You are not authorized to view this content.","ep_widget_cf_colors":"#D30C5C, #0EBCDC, #EAED41, #ED5A78, #DF33DF","ep_display_conditions":[],"ep_parallax_effects_transition_for":"all","ep_parallax_effects_transition_duration":"100","ep_parallax_effects_transition_easing":"linear","__globals__":{"advanced_button_text_color":"","button_background_color":"globals/colors?id=3ab82b4d","button_hover_background_color":"globals/colors?id=50006a26"},"advanced_button_padding":{"unit":"px","top":"7","right":"20","bottom":"7","left":"20","isLinked":false},"advanced_button_padding_tablet":{"unit":"px","top":"7","right":"20","bottom":"7","left":"20","isLinked":false},"ep_widget_cf_shapes":"square|circle","ep_widget_cf_shapes_emoji":"🎃|🎄|💜","ep_widget_cf_shapes_svg":"M167 72c19,-38 37,-56 75,-56 42,0 76,33 76,75 0,76 -76,151 -151,227 -76,-76 -151,-151 -151,-227 0,-42 33,-75 75,-75 38,0 57,18 76,56z|M120 240c-41,14 -91,18 -120,1 29,-10 57,-22 81,-40 -18,2 -37,3 -55,-3 25,-14 48,-30 66,-51 -11,5 -26,8 -45,7 20,-14 40,-30 57,-49 -13,1 -26,2 -38,-1 18,-11 35,-25 51,-43 -13,3 -24,5 -35,6 21,-19 40,-41 53,-67 14,26 32,48 54,67 -11,-1 -23,-3 -35,-6 15,18 32,32 51,43 -13,3 -26,2 -38,1 17,19 36,35 56,49 -19,1 -33,-2 -45,-7 19,21 42,37 67,51 -19,6 -37,5 -56,3 25,18 53,30 82,40 -30,17 -79,13 -120,-1l0 41 -31 0 0 -41z|M449.4 142c-5 0-10 .3-15 1a183 183 0 0 0-66.9-19.1V87.5a17.5 17.5 0 1 0-35 0v36.4a183 183 0 0 0-67 19c-4.9-.6-9.9-1-14.8-1C170.3 142 105 219.6 105 315s65.3 173 145.7 173c5 0 10-.3 14.8-1a184.7 184.7 0 0 0 169 0c4.9.7 9.9 1 14.9 1 80.3 0 145.6-77.6 145.6-173s-65.3-173-145.7-173zm-220 138 27.4-40.4a11.6 11.6 0 0 1 16.4-2.7l54.7 40.3a11.3 11.3 0 0 1-7 20.3H239a11.3 11.3 0 0 1-9.6-17.5zM444 383.8l-43.7 17.5a17.7 17.7 0 0 1-13 0l-37.3-15-37.2 15a17.8 17.8 0 0 1-13 0L256 383.8a17.5 17.5 0 0 1 13-32.6l37.3 15 37.2-15c4.2-1.6 8.8-1.6 13 0l37.3 15 37.2-15a17.5 17.5 0 0 1 13 32.6zm17-86.3h-82a11.3 11.3 0 0 1-6.9-20.4l54.7-40.3a11.6 11.6 0 0 1 16.4 2.8l27.4 40.4a11.3 11.3 0 0 1-9.6 17.5z","add_custom_attributes":"","custom_attributes":"","button_size":"md","onclick":"","onclick_event":"","align_tablet":"","align_mobile":"","button_icon":{"value":"","library":""},"icon_align_choose":"center","icon_align":"right","icon_indent":{"unit":"px","size":8,"sizes":[]},"show_button_badge":"","badge_align":"right","badge_indent":{"unit":"px","size":8,"sizes":[]},"button_css_id":"","attention_button":"","button_background_gradient_notice":"","button_background_color":"","button_background_color_stop":{"unit":"%","size":0,"sizes":[]},"button_background_color_stop_tablet":{"unit":"%"},"button_background_color_stop_mobile":{"unit":"%"},"button_background_color_b":"#f2295b","button_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"button_background_color_b_stop_tablet":{"unit":"%"},"button_background_color_b_stop_mobile":{"unit":"%"},"button_background_gradient_type":"linear","button_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"button_background_gradient_angle_tablet":{"unit":"deg"},"button_background_gradient_angle_mobile":{"unit":"deg"},"button_background_gradient_position":"center center","button_background_image":{"url":"","id":"","size":""},"button_background_image_tablet":{"url":"","id":"","size":""},"button_background_image_mobile":{"url":"","id":"","size":""},"button_background_position":"","button_background_position_tablet":"","button_background_position_mobile":"","button_background_xpos":{"unit":"px","size":0,"sizes":[]},"button_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"button_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"button_background_ypos":{"unit":"px","size":0,"sizes":[]},"button_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"button_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"button_background_attachment":"","button_background_repeat":"","button_background_repeat_tablet":"","button_background_repeat_mobile":"","button_background_size":"","button_background_size_tablet":"","button_background_size_mobile":"","button_background_bg_width":{"unit":"%","size":100,"sizes":[]},"button_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"button_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"button_background_video_link":"","button_background_video_start":"","button_background_video_end":"","button_background_play_once":"","button_background_play_on_mobile":"","button_background_privacy_mode":"","button_background_video_fallback":{"url":"","id":"","size":""},"button_background_slideshow_gallery":[],"button_background_slideshow_loop":"yes","button_background_slideshow_slide_duration":5000,"button_background_slideshow_slide_transition":"fade","button_background_slideshow_transition_duration":500,"button_background_slideshow_background_size":"","button_background_slideshow_background_size_tablet":"","button_background_slideshow_background_size_mobile":"","button_background_slideshow_background_position":"","button_background_slideshow_background_position_tablet":"","button_background_slideshow_background_position_mobile":"","button_background_slideshow_lazyload":"","button_background_slideshow_ken_burns":"","button_background_slideshow_ken_burns_zoom_direction":"in","button_border_width":{"unit":"px","top":3,"right":3,"bottom":3,"left":3,"isLinked":true},"button_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_border_color":"#666","advanced_button_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_shadow_box_shadow_type":"","advanced_button_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"advanced_button_shadow_box_shadow_position":" ","advanced_button_typography_typography":"","advanced_button_typography_font_family":"","advanced_button_typography_font_size":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_font_size_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_font_size_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_font_weight":"","advanced_button_typography_text_transform":"","advanced_button_typography_font_style":"","advanced_button_typography_text_decoration":"","advanced_button_typography_line_height":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_line_height_tablet":{"unit":"em","size":"","sizes":[]},"advanced_button_typography_line_height_mobile":{"unit":"em","size":"","sizes":[]},"advanced_button_typography_letter_spacing":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_letter_spacing_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_letter_spacing_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_word_spacing":{"unit":"px","size":"","sizes":[]},"advanced_button_typography_word_spacing_tablet":{"unit":"em","size":"","sizes":[]},"advanced_button_typography_word_spacing_mobile":{"unit":"em","size":"","sizes":[]},"button_width":{"unit":"px","size":"","sizes":[]},"button_width_tablet":{"unit":"px","size":"","sizes":[]},"button_width_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_hover_text_color":"","button_hover_background_gradient_notice":"","button_hover_background_color":"","button_hover_background_color_stop":{"unit":"%","size":0,"sizes":[]},"button_hover_background_color_stop_tablet":{"unit":"%"},"button_hover_background_color_stop_mobile":{"unit":"%"},"button_hover_background_color_b":"#f2295b","button_hover_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"button_hover_background_color_b_stop_tablet":{"unit":"%"},"button_hover_background_color_b_stop_mobile":{"unit":"%"},"button_hover_background_gradient_type":"linear","button_hover_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"button_hover_background_gradient_angle_tablet":{"unit":"deg"},"button_hover_background_gradient_angle_mobile":{"unit":"deg"},"button_hover_background_gradient_position":"center center","button_hover_background_image":{"url":"","id":"","size":""},"button_hover_background_image_tablet":{"url":"","id":"","size":""},"button_hover_background_image_mobile":{"url":"","id":"","size":""},"button_hover_background_position":"","button_hover_background_position_tablet":"","button_hover_background_position_mobile":"","button_hover_background_xpos":{"unit":"px","size":0,"sizes":[]},"button_hover_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"button_hover_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"button_hover_background_ypos":{"unit":"px","size":0,"sizes":[]},"button_hover_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"button_hover_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"button_hover_background_attachment":"","button_hover_background_repeat":"","button_hover_background_repeat_tablet":"","button_hover_background_repeat_mobile":"","button_hover_background_size":"","button_hover_background_size_tablet":"","button_hover_background_size_mobile":"","button_hover_background_bg_width":{"unit":"%","size":100,"sizes":[]},"button_hover_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"button_hover_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"button_hover_background_video_link":"","button_hover_background_video_start":"","button_hover_background_video_end":"","button_hover_background_play_once":"","button_hover_background_play_on_mobile":"","button_hover_background_privacy_mode":"","button_hover_background_video_fallback":{"url":"","id":"","size":""},"button_hover_background_slideshow_gallery":[],"button_hover_background_slideshow_loop":"yes","button_hover_background_slideshow_slide_duration":5000,"button_hover_background_slideshow_slide_transition":"fade","button_hover_background_slideshow_transition_duration":500,"button_hover_background_slideshow_background_size":"","button_hover_background_slideshow_background_size_tablet":"","button_hover_background_slideshow_background_size_mobile":"","button_hover_background_slideshow_background_position":"","button_hover_background_slideshow_background_position_tablet":"","button_hover_background_slideshow_background_position_mobile":"","button_hover_background_slideshow_lazyload":"","button_hover_background_slideshow_ken_burns":"","button_hover_background_slideshow_ken_burns_zoom_direction":"in","button_hover_border_width":{"unit":"px","top":3,"right":3,"bottom":3,"left":3,"isLinked":true},"button_hover_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_hover_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"button_hover_border_color":"","advanced_button_hover_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_hover_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_hover_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_hover_shadow_box_shadow_type":"","advanced_button_hover_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"advanced_button_hover_shadow_box_shadow_position":" ","hover_animation":"","advanced_button_icon_color":"","advanced_button_icon_background_background":"","advanced_button_icon_background_gradient_notice":"","advanced_button_icon_background_color":"","advanced_button_icon_background_color_stop":{"unit":"%","size":0,"sizes":[]},"advanced_button_icon_background_color_stop_tablet":{"unit":"%"},"advanced_button_icon_background_color_stop_mobile":{"unit":"%"},"advanced_button_icon_background_color_b":"#f2295b","advanced_button_icon_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_background_color_b_stop_tablet":{"unit":"%"},"advanced_button_icon_background_color_b_stop_mobile":{"unit":"%"},"advanced_button_icon_background_gradient_type":"linear","advanced_button_icon_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"advanced_button_icon_background_gradient_angle_tablet":{"unit":"deg"},"advanced_button_icon_background_gradient_angle_mobile":{"unit":"deg"},"advanced_button_icon_background_gradient_position":"center center","advanced_button_icon_background_image":{"url":"","id":"","size":""},"advanced_button_icon_background_image_tablet":{"url":"","id":"","size":""},"advanced_button_icon_background_image_mobile":{"url":"","id":"","size":""},"advanced_button_icon_background_position":"","advanced_button_icon_background_position_tablet":"","advanced_button_icon_background_position_mobile":"","advanced_button_icon_background_xpos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_ypos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_background_attachment":"","advanced_button_icon_background_repeat":"","advanced_button_icon_background_repeat_tablet":"","advanced_button_icon_background_repeat_mobile":"","advanced_button_icon_background_size":"","advanced_button_icon_background_size_tablet":"","advanced_button_icon_background_size_mobile":"","advanced_button_icon_background_bg_width":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_background_video_link":"","advanced_button_icon_background_video_start":"","advanced_button_icon_background_video_end":"","advanced_button_icon_background_play_once":"","advanced_button_icon_background_play_on_mobile":"","advanced_button_icon_background_privacy_mode":"","advanced_button_icon_background_video_fallback":{"url":"","id":"","size":""},"advanced_button_icon_background_slideshow_gallery":[],"advanced_button_icon_background_slideshow_loop":"yes","advanced_button_icon_background_slideshow_slide_duration":5000,"advanced_button_icon_background_slideshow_slide_transition":"fade","advanced_button_icon_background_slideshow_transition_duration":500,"advanced_button_icon_background_slideshow_background_size":"","advanced_button_icon_background_slideshow_background_size_tablet":"","advanced_button_icon_background_slideshow_background_size_mobile":"","advanced_button_icon_background_slideshow_background_position":"","advanced_button_icon_background_slideshow_background_position_tablet":"","advanced_button_icon_background_slideshow_background_position_mobile":"","advanced_button_icon_background_slideshow_lazyload":"","advanced_button_icon_background_slideshow_ken_burns":"","advanced_button_icon_background_slideshow_ken_burns_zoom_direction":"in","advanced_button_icon_border_border":"","advanced_button_icon_border_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_border_color":"","advanced_button_icon_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_padding":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_padding_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"advanced_button_icon_shadow_box_shadow_type":"","advanced_button_icon_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"advanced_button_icon_shadow_box_shadow_position":" ","advanced_button_icon_size":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_size_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_size_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_hover_icon_color":"","advanced_button_icon_hover_background_background":"","advanced_button_icon_hover_background_gradient_notice":"","advanced_button_icon_hover_background_color":"","advanced_button_icon_hover_background_color_stop":{"unit":"%","size":0,"sizes":[]},"advanced_button_icon_hover_background_color_stop_tablet":{"unit":"%"},"advanced_button_icon_hover_background_color_stop_mobile":{"unit":"%"},"advanced_button_icon_hover_background_color_b":"#f2295b","advanced_button_icon_hover_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_hover_background_color_b_stop_tablet":{"unit":"%"},"advanced_button_icon_hover_background_color_b_stop_mobile":{"unit":"%"},"advanced_button_icon_hover_background_gradient_type":"linear","advanced_button_icon_hover_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"advanced_button_icon_hover_background_gradient_angle_tablet":{"unit":"deg"},"advanced_button_icon_hover_background_gradient_angle_mobile":{"unit":"deg"},"advanced_button_icon_hover_background_gradient_position":"center center","advanced_button_icon_hover_background_image":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_image_tablet":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_image_mobile":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_position":"","advanced_button_icon_hover_background_position_tablet":"","advanced_button_icon_hover_background_position_mobile":"","advanced_button_icon_hover_background_xpos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_ypos":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"advanced_button_icon_hover_background_attachment":"","advanced_button_icon_hover_background_repeat":"","advanced_button_icon_hover_background_repeat_tablet":"","advanced_button_icon_hover_background_repeat_mobile":"","advanced_button_icon_hover_background_size":"","advanced_button_icon_hover_background_size_tablet":"","advanced_button_icon_hover_background_size_mobile":"","advanced_button_icon_hover_background_bg_width":{"unit":"%","size":100,"sizes":[]},"advanced_button_icon_hover_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_hover_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"advanced_button_icon_hover_background_video_link":"","advanced_button_icon_hover_background_video_start":"","advanced_button_icon_hover_background_video_end":"","advanced_button_icon_hover_background_play_once":"","advanced_button_icon_hover_background_play_on_mobile":"","advanced_button_icon_hover_background_privacy_mode":"","advanced_button_icon_hover_background_video_fallback":{"url":"","id":"","size":""},"advanced_button_icon_hover_background_slideshow_gallery":[],"advanced_button_icon_hover_background_slideshow_loop":"yes","advanced_button_icon_hover_background_slideshow_slide_duration":5000,"advanced_button_icon_hover_background_slideshow_slide_transition":"fade","advanced_button_icon_hover_background_slideshow_transition_duration":500,"advanced_button_icon_hover_background_slideshow_background_size":"","advanced_button_icon_hover_background_slideshow_background_size_tablet":"","advanced_button_icon_hover_background_slideshow_background_size_mobile":"","advanced_button_icon_hover_background_slideshow_background_position":"","advanced_button_icon_hover_background_slideshow_background_position_tablet":"","advanced_button_icon_hover_background_slideshow_background_position_mobile":"","advanced_button_icon_hover_background_slideshow_lazyload":"","advanced_button_icon_hover_background_slideshow_ken_burns":"","advanced_button_icon_hover_background_slideshow_ken_burns_zoom_direction":"in","icon_hover_border_color":"","badge_color":"","badge_background_background":"","badge_background_gradient_notice":"","badge_background_color":"","badge_background_color_stop":{"unit":"%","size":0,"sizes":[]},"badge_background_color_stop_tablet":{"unit":"%"},"badge_background_color_stop_mobile":{"unit":"%"},"badge_background_color_b":"#f2295b","badge_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"badge_background_color_b_stop_tablet":{"unit":"%"},"badge_background_color_b_stop_mobile":{"unit":"%"},"badge_background_gradient_type":"linear","badge_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"badge_background_gradient_angle_tablet":{"unit":"deg"},"badge_background_gradient_angle_mobile":{"unit":"deg"},"badge_background_gradient_position":"center center","badge_background_image":{"url":"","id":"","size":""},"badge_background_image_tablet":{"url":"","id":"","size":""},"badge_background_image_mobile":{"url":"","id":"","size":""},"badge_background_position":"","badge_background_position_tablet":"","badge_background_position_mobile":"","badge_background_xpos":{"unit":"px","size":0,"sizes":[]},"badge_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_background_ypos":{"unit":"px","size":0,"sizes":[]},"badge_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_background_attachment":"","badge_background_repeat":"","badge_background_repeat_tablet":"","badge_background_repeat_mobile":"","badge_background_size":"","badge_background_size_tablet":"","badge_background_size_mobile":"","badge_background_bg_width":{"unit":"%","size":100,"sizes":[]},"badge_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"badge_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"badge_background_video_link":"","badge_background_video_start":"","badge_background_video_end":"","badge_background_play_once":"","badge_background_play_on_mobile":"","badge_background_privacy_mode":"","badge_background_video_fallback":{"url":"","id":"","size":""},"badge_background_slideshow_gallery":[],"badge_background_slideshow_loop":"yes","badge_background_slideshow_slide_duration":5000,"badge_background_slideshow_slide_transition":"fade","badge_background_slideshow_transition_duration":500,"badge_background_slideshow_background_size":"","badge_background_slideshow_background_size_tablet":"","badge_background_slideshow_background_size_mobile":"","badge_background_slideshow_background_position":"","badge_background_slideshow_background_position_tablet":"","badge_background_slideshow_background_position_mobile":"","badge_background_slideshow_lazyload":"","badge_background_slideshow_ken_burns":"","badge_background_slideshow_ken_burns_zoom_direction":"in","badge_border_border":"","badge_border_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_border_color":"","badge_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_padding":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_padding_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"badge_shadow_box_shadow_type":"","badge_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"badge_shadow_box_shadow_position":" ","badge_typography_typography":"","badge_typography_font_family":"","badge_typography_font_size":{"unit":"px","size":"","sizes":[]},"badge_typography_font_size_tablet":{"unit":"px","size":"","sizes":[]},"badge_typography_font_size_mobile":{"unit":"px","size":"","sizes":[]},"badge_typography_font_weight":"","badge_typography_text_transform":"","badge_typography_font_style":"","badge_typography_text_decoration":"","badge_typography_line_height":{"unit":"px","size":"","sizes":[]},"badge_typography_line_height_tablet":{"unit":"em","size":"","sizes":[]},"badge_typography_line_height_mobile":{"unit":"em","size":"","sizes":[]},"badge_typography_letter_spacing":{"unit":"px","size":"","sizes":[]},"badge_typography_letter_spacing_tablet":{"unit":"px","size":"","sizes":[]},"badge_typography_letter_spacing_mobile":{"unit":"px","size":"","sizes":[]},"badge_typography_word_spacing":{"unit":"px","size":"","sizes":[]},"badge_typography_word_spacing_tablet":{"unit":"em","size":"","sizes":[]},"badge_typography_word_spacing_mobile":{"unit":"em","size":"","sizes":[]},"badge_hover_icon_color":"","badge_hover_background_background":"","badge_hover_background_gradient_notice":"","badge_hover_background_color":"","badge_hover_background_color_stop":{"unit":"%","size":0,"sizes":[]},"badge_hover_background_color_stop_tablet":{"unit":"%"},"badge_hover_background_color_stop_mobile":{"unit":"%"},"badge_hover_background_color_b":"#f2295b","badge_hover_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"badge_hover_background_color_b_stop_tablet":{"unit":"%"},"badge_hover_background_color_b_stop_mobile":{"unit":"%"},"badge_hover_background_gradient_type":"linear","badge_hover_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"badge_hover_background_gradient_angle_tablet":{"unit":"deg"},"badge_hover_background_gradient_angle_mobile":{"unit":"deg"},"badge_hover_background_gradient_position":"center center","badge_hover_background_image":{"url":"","id":"","size":""},"badge_hover_background_image_tablet":{"url":"","id":"","size":""},"badge_hover_background_image_mobile":{"url":"","id":"","size":""},"badge_hover_background_position":"","badge_hover_background_position_tablet":"","badge_hover_background_position_mobile":"","badge_hover_background_xpos":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_ypos":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"badge_hover_background_attachment":"","badge_hover_background_repeat":"","badge_hover_background_repeat_tablet":"","badge_hover_background_repeat_mobile":"","badge_hover_background_size":"","badge_hover_background_size_tablet":"","badge_hover_background_size_mobile":"","badge_hover_background_bg_width":{"unit":"%","size":100,"sizes":[]},"badge_hover_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"badge_hover_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"badge_hover_background_video_link":"","badge_hover_background_video_start":"","badge_hover_background_video_end":"","badge_hover_background_play_once":"","badge_hover_background_play_on_mobile":"","badge_hover_background_privacy_mode":"","badge_hover_background_video_fallback":{"url":"","id":"","size":""},"badge_hover_background_slideshow_gallery":[],"badge_hover_background_slideshow_loop":"yes","badge_hover_background_slideshow_slide_duration":5000,"badge_hover_background_slideshow_slide_transition":"fade","badge_hover_background_slideshow_transition_duration":500,"badge_hover_background_slideshow_background_size":"","badge_hover_background_slideshow_background_size_tablet":"","badge_hover_background_slideshow_background_size_mobile":"","badge_hover_background_slideshow_background_position":"","badge_hover_background_slideshow_background_position_tablet":"","badge_hover_background_slideshow_background_position_mobile":"","badge_hover_background_slideshow_lazyload":"","badge_hover_background_slideshow_ken_burns":"","badge_hover_background_slideshow_ken_burns_zoom_direction":"in","badge_hover_border_color":"","_title":"","_margin":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_margin_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_margin_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_padding":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_padding_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_padding_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_element_width":"","_element_width_tablet":"","_element_width_mobile":"","_element_custom_width":{"unit":"%","size":"","sizes":[]},"_element_custom_width_tablet":{"unit":"px","size":"","sizes":[]},"_element_custom_width_mobile":{"unit":"px","size":"","sizes":[]},"_element_vertical_align":"","_element_vertical_align_tablet":"","_element_vertical_align_mobile":"","_position_description":"","_position":"","_offset_orientation_h":"start","_offset_x":{"unit":"px","size":0,"sizes":[]},"_offset_x_tablet":{"unit":"px","size":"","sizes":[]},"_offset_x_mobile":{"unit":"px","size":"","sizes":[]},"_offset_x_end":{"unit":"px","size":0,"sizes":[]},"_offset_x_end_tablet":{"unit":"px","size":"","sizes":[]},"_offset_x_end_mobile":{"unit":"px","size":"","sizes":[]},"_offset_orientation_v":"start","_offset_y":{"unit":"px","size":0,"sizes":[]},"_offset_y_tablet":{"unit":"px","size":"","sizes":[]},"_offset_y_mobile":{"unit":"px","size":"","sizes":[]},"_offset_y_end":{"unit":"px","size":0,"sizes":[]},"_offset_y_end_tablet":{"unit":"px","size":"","sizes":[]},"_offset_y_end_mobile":{"unit":"px","size":"","sizes":[]},"_z_index":"","_z_index_tablet":"","_z_index_mobile":"","_element_id":"","_css_classes":"","wcm_element_visibility_condition":"visible_to_everyone","wcm_element_visibility_show_plans":["wcm-all"],"wcm_element_visibility_hide_plans":["wcm-none"],"wcm_element_visibility_show_content_restricted_message":"","ep_widget_cf_confetti":"","ep_widget_cf_type":"basic","ep_widget_cf_fireworks_duration":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_anim_infinite":"","ep_widget_cf_particle_count":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_start_velocity":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_spread":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_angle":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_shape_type":"basic","ep_widget_cf_scalar":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_origin":"","ep_widget_cf_origin_x":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_origin_y":{"unit":"px","size":"","sizes":[]},"ep_widget_cf_trigger_type":"load","ep_widget_cf_trigger_selector":"","ep_widget_cf_trigger_delay":{"unit":"px","size":3000,"sizes":[]},"ep_widget_cf_z_index":"","ep_display_conditions_enable":"","ep_display_conditions_to":"show","ep_display_conditions_relation":"all","ep_floating_effects_show":"","ep_floating_effects_translate_toggle":"","ep_floating_effects_translate_x":{"unit":"px","size":"","sizes":{"from":0,"to":0}},"ep_floating_effects_translate_y":{"unit":"px","size":"","sizes":{"from":0,"to":30}},"ep_floating_effects_translate_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_translate_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_rotate_toggle":"","ep_floating_effects_rotate_x":{"unit":"deg","size":"","sizes":{"from":0,"to":0}},"ep_floating_effects_rotate_y":{"unit":"deg","size":"","sizes":{"from":0,"to":0}},"ep_floating_effects_rotate_z":{"unit":"deg","size":"","sizes":{"from":0,"to":45}},"ep_floating_effects_rotate_infinite":"","ep_floating_effects_rotate_duration":{"unit":"px","size":2000,"sizes":[]},"ep_floating_effects_rotate_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_scale_toggle":"","ep_floating_effects_scale_x":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_scale_y":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_scale_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_scale_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_skew_toggle":"","ep_floating_effects_skew_x":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_skew_y":{"unit":"px","size":"","sizes":{"from":1,"to":1.5}},"ep_floating_effects_skew_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_skew_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_border_radius_toggle":"","ep_floating_effects_border_radius":{"unit":"px","size":"","sizes":{"from":0,"to":50}},"ep_floating_effects_border_radius_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_border_radius_delay":{"unit":"px","size":"","sizes":[]},"ep_floating_effects_opacity_toggle":"","ep_floating_effects_opacity_start":{"unit":"px","size":1,"sizes":[]},"ep_floating_effects_opacity_end":{"unit":"px","size":0,"sizes":[]},"ep_floating_effects_opacity_duration":{"unit":"px","size":1000,"sizes":[]},"ep_floating_effects_easing":"easeInOutQuad","ep_parallax_effects_show":"","ep_parallax_effects_x":"","ep_parallax_effects_x_start":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_x_end":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_x_custom_show":"","ep_parallax_effects_x_custom_value":"","ep_parallax_effects_y":"","ep_parallax_effects_y_start":{"unit":"px","size":50,"sizes":[]},"ep_parallax_effects_y_end":{"unit":"px","size":0,"sizes":[]},"ep_parallax_effects_y_custom_show":"","ep_parallax_effects_y_custom_value":"","ep_parallax_effects_opacity_toggole":"","ep_parallax_effects_opacity":"","ep_parallax_effects_opacity_custom_show":"","ep_parallax_effects_opacity_custom_value":"","ep_parallax_effects_blur":"","ep_parallax_effects_blur_start":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_blur_end":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_rotate":"","ep_parallax_effects_rotate_start":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_rotate_end":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_scale":"","ep_parallax_effects_scale_start":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_scale_end":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_hue":"","ep_parallax_effects_hue_value":{"unit":"px","size":"","sizes":[]},"ep_parallax_effects_sepia":"","ep_parallax_effects_sepia_value":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_easing":"","ep_parallax_effects_easing_value":{"unit":"px","size":1,"sizes":[]},"ep_parallax_effects_transition":"","ep_parallax_effects_viewport":"","ep_parallax_effects_viewport_start":"","ep_parallax_effects_viewport_end":"","ep_parallax_effects_media_query":"","ep_parallax_effects_target":"self","motion_fx_motion_fx_scrolling":"","motion_fx_translateY_effect":"","motion_fx_translateY_direction":"","motion_fx_translateY_speed":{"unit":"px","size":4,"sizes":[]},"motion_fx_translateY_affectedRange":{"unit":"%","size":"","sizes":{"start":0,"end":100}},"motion_fx_translateX_effect":"","motion_fx_translateX_direction":"","motion_fx_translateX_speed":{"unit":"px","size":4,"sizes":[]},"motion_fx_translateX_affectedRange":{"unit":"%","size":"","sizes":{"start":0,"end":100}},"motion_fx_opacity_effect":"","motion_fx_opacity_direction":"out-in","motion_fx_opacity_level":{"unit":"px","size":10,"sizes":[]},"motion_fx_opacity_range":{"unit":"%","size":"","sizes":{"start":20,"end":80}},"motion_fx_blur_effect":"","motion_fx_blur_direction":"out-in","motion_fx_blur_level":{"unit":"px","size":7,"sizes":[]},"motion_fx_blur_range":{"unit":"%","size":"","sizes":{"start":20,"end":80}},"motion_fx_rotateZ_effect":"","motion_fx_rotateZ_direction":"","motion_fx_rotateZ_speed":{"unit":"px","size":1,"sizes":[]},"motion_fx_rotateZ_affectedRange":{"unit":"%","size":"","sizes":{"start":0,"end":100}},"motion_fx_scale_effect":"","motion_fx_scale_direction":"out-in","motion_fx_scale_speed":{"unit":"px","size":4,"sizes":[]},"motion_fx_scale_range":{"unit":"%","size":"","sizes":{"start":20,"end":80}},"motion_fx_transform_origin_x":"center","motion_fx_transform_origin_y":"center","motion_fx_devices":["desktop","tablet","mobile"],"motion_fx_range":"","motion_fx_motion_fx_mouse":"","motion_fx_mouseTrack_effect":"","motion_fx_mouseTrack_direction":"","motion_fx_mouseTrack_speed":{"unit":"px","size":1,"sizes":[]},"motion_fx_tilt_effect":"","motion_fx_tilt_direction":"","motion_fx_tilt_speed":{"unit":"px","size":4,"sizes":[]},"sticky":"","sticky_on":["desktop","tablet","mobile"],"sticky_offset":0,"sticky_offset_tablet":"","sticky_offset_mobile":"","sticky_effects_offset":0,"sticky_effects_offset_tablet":"","sticky_effects_offset_mobile":"","sticky_parent":"","_animation":"","_animation_tablet":"","_animation_mobile":"","animation_duration":"","_animation_delay":"","_transform_rotate_popover":"","_transform_rotateZ_effect":{"unit":"px","size":"","sizes":[]},"_transform_rotateZ_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateZ_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotate_3d":"","_transform_rotateX_effect":{"unit":"px","size":"","sizes":[]},"_transform_rotateX_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateX_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect":{"unit":"px","size":"","sizes":[]},"_transform_rotateY_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_perspective_effect":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translate_popover":"","_transform_translateX_effect":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scale_popover":"","_transform_keep_proportions":"yes","_transform_scale_effect":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_mobile":{"unit":"px","size":"","sizes":[]},"_transform_skew_popover":"","_transform_skewX_effect":{"unit":"px","size":"","sizes":[]},"_transform_skewX_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewX_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect":{"unit":"px","size":"","sizes":[]},"_transform_skewY_effect_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_flipX_effect":"","_transform_flipY_effect":"","_transform_rotate_popover_hover":"","_transform_rotateZ_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_rotateZ_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateZ_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotate_3d_hover":"","_transform_rotateX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_rotateX_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateX_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_rotateY_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_rotateY_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_perspective_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_perspective_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translate_popover_hover":"","_transform_translateX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateX_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_translateY_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scale_popover_hover":"","_transform_keep_proportions_hover":"yes","_transform_scale_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scale_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleX_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_hover_tablet":{"unit":"px","size":"","sizes":[]},"_transform_scaleY_effect_hover_mobile":{"unit":"px","size":"","sizes":[]},"_transform_skew_popover_hover":"","_transform_skewX_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_skewX_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewX_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect_hover":{"unit":"px","size":"","sizes":[]},"_transform_skewY_effect_hover_tablet":{"unit":"deg","size":"","sizes":[]},"_transform_skewY_effect_hover_mobile":{"unit":"deg","size":"","sizes":[]},"_transform_flipX_effect_hover":"","_transform_flipY_effect_hover":"","_transform_transition_hover":{"unit":"px","size":"","sizes":[]},"motion_fx_transform_x_anchor_point":"","motion_fx_transform_x_anchor_point_tablet":"","motion_fx_transform_x_anchor_point_mobile":"","motion_fx_transform_y_anchor_point":"","motion_fx_transform_y_anchor_point_tablet":"","motion_fx_transform_y_anchor_point_mobile":"","_background_background":"","_background_gradient_notice":"","_background_color":"","_background_color_stop":{"unit":"%","size":0,"sizes":[]},"_background_color_stop_tablet":{"unit":"%"},"_background_color_stop_mobile":{"unit":"%"},"_background_color_b":"#f2295b","_background_color_b_stop":{"unit":"%","size":100,"sizes":[]},"_background_color_b_stop_tablet":{"unit":"%"},"_background_color_b_stop_mobile":{"unit":"%"},"_background_gradient_type":"linear","_background_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"_background_gradient_angle_tablet":{"unit":"deg"},"_background_gradient_angle_mobile":{"unit":"deg"},"_background_gradient_position":"center center","_background_image":{"url":"","id":"","size":""},"_background_image_tablet":{"url":"","id":"","size":""},"_background_image_mobile":{"url":"","id":"","size":""},"_background_position":"","_background_position_tablet":"","_background_position_mobile":"","_background_xpos":{"unit":"px","size":0,"sizes":[]},"_background_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_ypos":{"unit":"px","size":0,"sizes":[]},"_background_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_attachment":"","_background_repeat":"","_background_repeat_tablet":"","_background_repeat_mobile":"","_background_size":"","_background_size_tablet":"","_background_size_mobile":"","_background_bg_width":{"unit":"%","size":100,"sizes":[]},"_background_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"_background_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"_background_video_link":"","_background_video_start":"","_background_video_end":"","_background_play_once":"","_background_play_on_mobile":"","_background_privacy_mode":"","_background_video_fallback":{"url":"","id":"","size":""},"_background_slideshow_gallery":[],"_background_slideshow_loop":"yes","_background_slideshow_slide_duration":5000,"_background_slideshow_slide_transition":"fade","_background_slideshow_transition_duration":500,"_background_slideshow_background_size":"","_background_slideshow_background_size_tablet":"","_background_slideshow_background_size_mobile":"","_background_slideshow_background_position":"","_background_slideshow_background_position_tablet":"","_background_slideshow_background_position_mobile":"","_background_slideshow_lazyload":"","_background_slideshow_ken_burns":"","_background_slideshow_ken_burns_zoom_direction":"in","_background_hover_background":"","_background_hover_gradient_notice":"","_background_hover_color":"","_background_hover_color_stop":{"unit":"%","size":0,"sizes":[]},"_background_hover_color_stop_tablet":{"unit":"%"},"_background_hover_color_stop_mobile":{"unit":"%"},"_background_hover_color_b":"#f2295b","_background_hover_color_b_stop":{"unit":"%","size":100,"sizes":[]},"_background_hover_color_b_stop_tablet":{"unit":"%"},"_background_hover_color_b_stop_mobile":{"unit":"%"},"_background_hover_gradient_type":"linear","_background_hover_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"_background_hover_gradient_angle_tablet":{"unit":"deg"},"_background_hover_gradient_angle_mobile":{"unit":"deg"},"_background_hover_gradient_position":"center center","_background_hover_image":{"url":"","id":"","size":""},"_background_hover_image_tablet":{"url":"","id":"","size":""},"_background_hover_image_mobile":{"url":"","id":"","size":""},"_background_hover_position":"","_background_hover_position_tablet":"","_background_hover_position_mobile":"","_background_hover_xpos":{"unit":"px","size":0,"sizes":[]},"_background_hover_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_hover_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_hover_ypos":{"unit":"px","size":0,"sizes":[]},"_background_hover_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"_background_hover_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"_background_hover_attachment":"","_background_hover_repeat":"","_background_hover_repeat_tablet":"","_background_hover_repeat_mobile":"","_background_hover_size":"","_background_hover_size_tablet":"","_background_hover_size_mobile":"","_background_hover_bg_width":{"unit":"%","size":100,"sizes":[]},"_background_hover_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"_background_hover_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"_background_hover_video_link":"","_background_hover_video_start":"","_background_hover_video_end":"","_background_hover_play_once":"","_background_hover_play_on_mobile":"","_background_hover_privacy_mode":"","_background_hover_video_fallback":{"url":"","id":"","size":""},"_background_hover_slideshow_gallery":[],"_background_hover_slideshow_loop":"yes","_background_hover_slideshow_slide_duration":5000,"_background_hover_slideshow_slide_transition":"fade","_background_hover_slideshow_transition_duration":500,"_background_hover_slideshow_background_size":"","_background_hover_slideshow_background_size_tablet":"","_background_hover_slideshow_background_size_mobile":"","_background_hover_slideshow_background_position":"","_background_hover_slideshow_background_position_tablet":"","_background_hover_slideshow_background_position_mobile":"","_background_hover_slideshow_lazyload":"","_background_hover_slideshow_ken_burns":"","_background_hover_slideshow_ken_burns_zoom_direction":"in","_background_hover_transition":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_background":"","ep_background_overlay_gradient_notice":"","ep_background_overlay_color":"","ep_background_overlay_color_stop":{"unit":"%","size":0,"sizes":[]},"ep_background_overlay_color_stop_tablet":{"unit":"%"},"ep_background_overlay_color_stop_mobile":{"unit":"%"},"ep_background_overlay_color_b":"#f2295b","ep_background_overlay_color_b_stop":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_color_b_stop_tablet":{"unit":"%"},"ep_background_overlay_color_b_stop_mobile":{"unit":"%"},"ep_background_overlay_gradient_type":"linear","ep_background_overlay_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"ep_background_overlay_gradient_angle_tablet":{"unit":"deg"},"ep_background_overlay_gradient_angle_mobile":{"unit":"deg"},"ep_background_overlay_gradient_position":"center center","ep_background_overlay_image":{"url":"","id":"","size":""},"ep_background_overlay_image_tablet":{"url":"","id":"","size":""},"ep_background_overlay_image_mobile":{"url":"","id":"","size":""},"ep_background_overlay_position":"","ep_background_overlay_position_tablet":"","ep_background_overlay_position_mobile":"","ep_background_overlay_xpos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_ypos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_attachment":"","ep_background_overlay_repeat":"","ep_background_overlay_repeat_tablet":"","ep_background_overlay_repeat_mobile":"","ep_background_overlay_size":"","ep_background_overlay_size_tablet":"","ep_background_overlay_size_mobile":"","ep_background_overlay_bg_width":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_video_link":"","ep_background_overlay_video_start":"","ep_background_overlay_video_end":"","ep_background_overlay_play_once":"","ep_background_overlay_play_on_mobile":"","ep_background_overlay_privacy_mode":"","ep_background_overlay_video_fallback":{"url":"","id":"","size":""},"ep_background_overlay_slideshow_gallery":[],"ep_background_overlay_slideshow_loop":"yes","ep_background_overlay_slideshow_slide_duration":5000,"ep_background_overlay_slideshow_slide_transition":"fade","ep_background_overlay_slideshow_transition_duration":500,"ep_background_overlay_slideshow_background_size":"","ep_background_overlay_slideshow_background_size_tablet":"","ep_background_overlay_slideshow_background_size_mobile":"","ep_background_overlay_slideshow_background_position":"","ep_background_overlay_slideshow_background_position_tablet":"","ep_background_overlay_slideshow_background_position_mobile":"","ep_background_overlay_slideshow_lazyload":"","ep_background_overlay_slideshow_ken_burns":"","ep_background_overlay_slideshow_ken_burns_zoom_direction":"in","ep_background_overlay_opacity":{"unit":"px","size":0.5,"sizes":[]},"ep_css_filters_css_filter":"","ep_css_filters_blur":{"unit":"px","size":0,"sizes":[]},"ep_css_filters_brightness":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_contrast":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_saturate":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hue":{"unit":"px","size":0,"sizes":[]},"ep_overlay_blend_mode":"","ep_background_overlay_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_hover_background":"","ep_background_overlay_hover_gradient_notice":"","ep_background_overlay_hover_color":"","ep_background_overlay_hover_color_stop":{"unit":"%","size":0,"sizes":[]},"ep_background_overlay_hover_color_stop_tablet":{"unit":"%"},"ep_background_overlay_hover_color_stop_mobile":{"unit":"%"},"ep_background_overlay_hover_color_b":"#f2295b","ep_background_overlay_hover_color_b_stop":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_hover_color_b_stop_tablet":{"unit":"%"},"ep_background_overlay_hover_color_b_stop_mobile":{"unit":"%"},"ep_background_overlay_hover_gradient_type":"linear","ep_background_overlay_hover_gradient_angle":{"unit":"deg","size":180,"sizes":[]},"ep_background_overlay_hover_gradient_angle_tablet":{"unit":"deg"},"ep_background_overlay_hover_gradient_angle_mobile":{"unit":"deg"},"ep_background_overlay_hover_gradient_position":"center center","ep_background_overlay_hover_image":{"url":"","id":"","size":""},"ep_background_overlay_hover_image_tablet":{"url":"","id":"","size":""},"ep_background_overlay_hover_image_mobile":{"url":"","id":"","size":""},"ep_background_overlay_hover_position":"","ep_background_overlay_hover_position_tablet":"","ep_background_overlay_hover_position_mobile":"","ep_background_overlay_hover_xpos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_xpos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_xpos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_ypos":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_ypos_tablet":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_ypos_mobile":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_attachment":"","ep_background_overlay_hover_repeat":"","ep_background_overlay_hover_repeat_tablet":"","ep_background_overlay_hover_repeat_mobile":"","ep_background_overlay_hover_size":"","ep_background_overlay_hover_size_tablet":"","ep_background_overlay_hover_size_mobile":"","ep_background_overlay_hover_bg_width":{"unit":"%","size":100,"sizes":[]},"ep_background_overlay_hover_bg_width_tablet":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_hover_bg_width_mobile":{"unit":"px","size":"","sizes":[]},"ep_background_overlay_hover_video_link":"","ep_background_overlay_hover_video_start":"","ep_background_overlay_hover_video_end":"","ep_background_overlay_hover_play_once":"","ep_background_overlay_hover_play_on_mobile":"","ep_background_overlay_hover_privacy_mode":"","ep_background_overlay_hover_video_fallback":{"url":"","id":"","size":""},"ep_background_overlay_hover_slideshow_gallery":[],"ep_background_overlay_hover_slideshow_loop":"yes","ep_background_overlay_hover_slideshow_slide_duration":5000,"ep_background_overlay_hover_slideshow_slide_transition":"fade","ep_background_overlay_hover_slideshow_transition_duration":500,"ep_background_overlay_hover_slideshow_background_size":"","ep_background_overlay_hover_slideshow_background_size_tablet":"","ep_background_overlay_hover_slideshow_background_size_mobile":"","ep_background_overlay_hover_slideshow_background_position":"","ep_background_overlay_hover_slideshow_background_position_tablet":"","ep_background_overlay_hover_slideshow_background_position_mobile":"","ep_background_overlay_hover_slideshow_lazyload":"","ep_background_overlay_hover_slideshow_ken_burns":"","ep_background_overlay_hover_slideshow_ken_burns_zoom_direction":"in","ep_background_overlay_hover_opacity":{"unit":"px","size":0.5,"sizes":[]},"ep_css_filters_hover_css_filter":"","ep_css_filters_hover_blur":{"unit":"px","size":0,"sizes":[]},"ep_css_filters_hover_brightness":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hover_contrast":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hover_saturate":{"unit":"px","size":100,"sizes":[]},"ep_css_filters_hover_hue":{"unit":"px","size":0,"sizes":[]},"ep_background_overlay_hover_transition_duration":{"unit":"px","size":0.3,"sizes":[]},"ep_background_overlay_hover_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_hover_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_hover_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_margin":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_margin_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_margin_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"ep_background_overlay_zindex":"","ep_background_overlay_position_relative":"","ep_background_overlay_widget_zindex":"-1","_border_border":"","_border_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_color":"","_border_radius":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_box_shadow_box_shadow_type":"","_box_shadow_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"_box_shadow_box_shadow_position":" ","_border_hover_border":"","_border_hover_width":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_hover_width_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_hover_width_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_hover_color":"","_border_radius_hover":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_hover_tablet":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_border_radius_hover_mobile":{"unit":"px","top":"","right":"","bottom":"","left":"","isLinked":true},"_box_shadow_hover_box_shadow_type":"","_box_shadow_hover_box_shadow":{"horizontal":0,"vertical":0,"blur":10,"spread":0,"color":"rgba(0,0,0,0.5)"},"_box_shadow_hover_box_shadow_position":" ","_border_hover_transition":{"unit":"px","size":"","sizes":[]},"_mask_switch":"","_mask_shape":"circle","_mask_image":{"url":"","id":"","size":""},"_mask_notice":"","_mask_size":"contain","_mask_size_tablet":"","_mask_size_mobile":"","_mask_size_scale":{"unit":"%","size":100,"sizes":[]},"_mask_size_scale_tablet":{"unit":"px","size":"","sizes":[]},"_mask_size_scale_mobile":{"unit":"px","size":"","sizes":[]},"_mask_position":"center center","_mask_position_tablet":"","_mask_position_mobile":"","_mask_position_x":{"unit":"%","size":0,"sizes":[]},"_mask_position_x_tablet":{"unit":"px","size":"","sizes":[]},"_mask_position_x_mobile":{"unit":"px","size":"","sizes":[]},"_mask_position_y":{"unit":"%","size":0,"sizes":[]},"_mask_position_y_tablet":{"unit":"px","size":"","sizes":[]},"_mask_position_y_mobile":{"unit":"px","size":"","sizes":[]},"_mask_repeat":"no-repeat","_mask_repeat_tablet":"","_mask_repeat_mobile":"","hide_desktop":"","hide_tablet":"","hide_mobile":"","_attributes":"","custom_css":""},"defaultEditSettings":{"defaultEditRoute":"content"},"elements":[],"widgetType":"bdt-advanced-button","editSettings":{"defaultEditRoute":"content"},"htmlCache":""}]}](https://consultorsalud.com/wp-content/uploads/2024/03/1080x1080_portal_central-de-mezclas_01-1.jpg)
